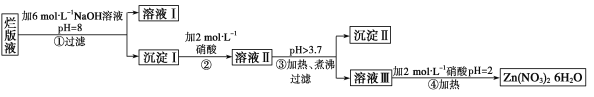
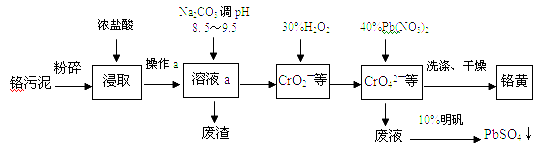
题目内容
【题目】已知牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其他成分遇到盐酸时无气体产生。某兴趣小组对摩擦剂成分及其含量进行以下探究:
Ⅰ.摩擦剂中氢氧化铝的定性检验
取适量牙膏样品,加水充分搅拌、过滤。
(1)往滤渣中加入过量NaOH溶液,过滤。氢氧化铝与NaOH溶液反应的离子方程式是______________。
(2)往(1)所得滤液中通入过量二氧化碳,主要发生反应的离子方程式是 。
Ⅱ.牙膏样品中碳酸钙的定量测定
利用下图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定C中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数。
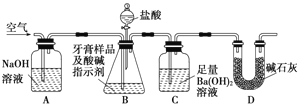
依据实验过程回答下列问题:
(3)D装置的作用是 ;
(4)实验过程中需持续缓缓通入空气。其作用除了可搅拌B、C中的反应物外,还有:______________。
(5)下列各项措施中,不能提高测定准确度的是________________(填标号)。
a.在加入盐酸之前,应排净装置内的CO2气体
b.滴加盐酸不宜过快
c.在A~B之间增添盛有浓硫酸的洗气装置
d.在B~C之间增添盛有饱和碳酸氢钠溶液的洗气装置
(6)有人认为不必测定C中生成的BaCO3质量,只要测定装置C在吸收CO2前后的质量差,一样可以确定碳酸钙的质量分数。实验证明按此方法测定的结果明显偏高,原因是_____________。
【答案】Ⅰ.(1)Al(OH)3+OH-===AlO![]() +2H2O(2分)
+2H2O(2分)
(2)CO2+AlO![]() +2H2O=Al(OH)3↓+HCO3-(2分)
+2H2O=Al(OH)3↓+HCO3-(2分)
Ⅱ.(3)防止空气中的CO2进入C中(1分)
(4)把生成的CO2全部排入C中,使之完全被Ba(OH)2溶液吸收(1分)
(5)cd(2分)
(6)B中的氯化氢气体等进入装置C中(或其他合理答案)(2分)
【解析】
试题分析:
Ⅰ.(1)Al(OH)3与NaOH溶液反应生成NaAlO2与水,反应离子方程式为Al(OH)3+OH-===AlO![]() +2H2O;
+2H2O;
(2)(1)所得滤液中主要是NaAlO2和过量的NaOH,通入过量二氧化碳,发生的主要反应是CO2 +AlO![]() +2H2O= Al(OH)3↓+ HCO3-;
+2H2O= Al(OH)3↓+ HCO3-;
Ⅱ.由装置图分析,B中样品中的碳酸钙与盐酸反应产生CO2气体,通入C中,被Ba(OH)2溶液吸收,产生BaCO3沉淀,通过BaCO3的质量来计算样品中碳酸钙的质量分数。为将装置中残留的部分二氧化碳完全通入C中,故需持续缓缓通入空气,由于空气中也存在CO2,为减少误差,设计A装置来除去空气中的CO2,而装置D则是为了避免右端空气中的CO2气体进入C中与Ba(OH)2溶液反应导致沉淀质量偏大。
(3)据上述分析,可知D装置的作用是防止空气中的CO2进入C中;
(4)装置中残留部分二氧化碳,不能被完全吸收,导致测定的碳酸钡的质量偏小,所以实验过程中持续缓缓通入空气的作用除了可搅拌B、C中的反应物外,还有把生成的CO2全部排入C中,使之完全被Ba(OH)2溶液吸收。
(5)a.在加入盐酸之前,应排净装置内的CO2气体,防止影响碳酸钡质量的测定,可以提高测定准确度;b.滴加盐酸过快产生的CO2来不及被吸收,就排出装置C,所以滴加盐酸不宜过快,使二氧化碳吸收完全,可以提高测定准确度;c.在A~B之间增添盛有浓硫酸的洗气装置,吸收水分,不影响CO2,不能提高提高测定准确度;d.在B~C之间增添盛有饱和碳酸氢钠溶液的洗气装置,可以吸收挥发出的HCl,与碳酸氢钠溶液反应产生更多的CO2,不能提高测定准确度。故选cd。
(6)B中的氯化氢气体等进入装置C中,导致测定装置C在吸收CO2前后的质量差偏大。

 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案【题目】有A、B、C、D、E五种常见化合物,都是由下表中的离子形成的:
阳离子 | K+ Na+ Cu2+ Al3+ |
阴离子 | SO42﹣ HCO3﹣ NO3﹣ OH﹣ |
为了鉴别上述化合物。分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,只有B为紫色(透过蓝色钴玻璃);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀;
⑤将B、D两溶液混合,未见沉淀或气体生成。
根据上述实验填空:
(1)写出B、D的化学式:B ,D 。
(2)将含1mol A的溶液与含1mol E的溶液反应后蒸干,仅得到一种化合物,该化合物的化学式为 。
(3)在A溶液中加少入量澄清石灰水,其离子方程式为 。
(4)C常用作净水剂,用离子方程式表示其净水原理 。