��Ŀ����
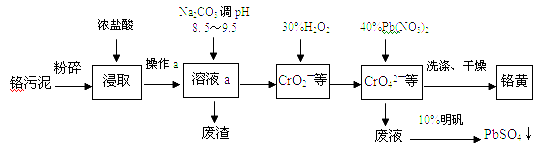
����Ŀ���ú���Al2O3��SiO2������FeOxFe2O3�������Ʊ�Al2��SO4��318H2O����������������
��һ�������£�MnO4-����Mn2����Ӧ����MnO2)
��֪�������������������PH

��1��H2SO4�ܽ�Al2O3�����ӷ���ʽ��____________��
��2��������Һ�л�����Fe2+�ķ�����______________��
��3�������������������¼������裺��I������Һ�м������KMnO4��Һ��������Һ��pHΪ3.2 ��II�����ȣ�����������ɫ���������ã��ϲ���Һ���Ϻ�ɫ��(��������MnSO4���Ϻ�ɫ��ʧ�����ˡ�
������I ��Ŀ���ǣ�_________��������Һ��pHΪ3.2��Ŀ����__________��
������II�ij����м���ŨHCl�����ȣ��л���ɫ�������ɣ�д���䷴Ӧ����ʽ______��
���������м���MnSO4��Ŀ����__________�������ӷ�Ӧ����ʽ��ʾ��
��4���Ӷ��ѭ��ʹ�ú�ĸҺ�пɻ��յ���Ҫ������________���ѧʽ����
���𰸡���1��Al2O3��6H����2Al3����3H2O
��2��ȡ������Һ���Թܣ��μ�����KMnO4��Һ��KMnO4��Һ��ɫ����˵����Fe2����
��3������Fe2+����ΪFe3+������pHֵʹ����ȫ������
��MnO2��4HCl![]() MnCl2��Cl2����2H2O
MnCl2��Cl2����2H2O
��Mn2����MnO4����2H2O��MnO2��4H��
��4��K2SO4��
��������
�����������1�������ܽ�������������������ˮ����Ӧ�����ӷ���ʽΪ��Al2O3 + 6H+ = 2Al3+ + 3H2O����2������KMnO4��Һ��Fe2+��Ӧ��MnO4-����ԭ��Mn2+����Һ��ɫ����3��������Һ�м������KMnO4��Һ��Ŀ����Fe2+����ΪFe3+������ͼ�����ݷ�����֪��Fe3+��ʼ�����ͳ�����ȫ����ҺpHΪ1.5��2.8��Al3+��Fe2+��ʼ��������ҺpH����3�����Ե�����Һ��pHԼΪ3������ʹFe3+ȫ��������Al3+������,�ﵽ���룻��һ�������£�MnO4������Mn2+��Ӧ����MnO2.�����ij����м���ŨHCl�����ȣ�MnO2 + 4HCl��Ũ��== MnCl2 + Cl2��+ 2H2O����MnO4������Mn2+��Ӧ����MnO2�����˳�ȥ�����Կ�������MnSO4��Һ��KMnO4��Һ��Ӧ����MnO2���ѹ���MnO4����ȥ��

 53���ò�ϵ�д�
53���ò�ϵ�д�����Ŀ�������������Һ��ϡ���ᷴӦ�Ļ�ѧ����ʽΪ�� Na2S203+H2S04=Na2S04+S02+S��+H20�����и���ʵ�������ȳ��ֻ��ǵ��ǣ� ��
ʵ�� | ��Ӧ������ | Na2SO4 | Na2S2O3 ��Һ | ϡ H2SO4 | H2O | |
V/mL | c/ (moL-L-1) | V/mL | d (moL-L-1) | V/mL | ||
A | 25 | 5 �� | 0.1 | 10 | 0.1 | 5 |
B | 25 | 5 | 0.2 | 5 | 0.2 | 10 |
C | 35 | 5 | 0.1 | 10 | 0.1 | 5 |
D | 35 | 5 | 0.2 | 5 | 0.2 | 10 |