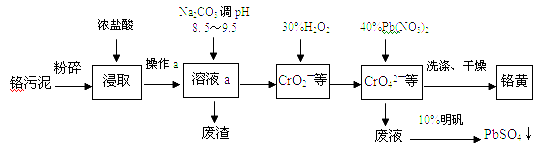
题目内容
【题目】过氧化尿素是一种新型漂白、消毒剂,广泛应用于农业、医药、日用化工等领域。用低浓度的双氧水和饱和尿素溶液在一定条件下可以合成过氧化尿素:反应的方程式为:
CO(NH2)2+H2O2![]() CO(NH)2·H2O2。过氧化尿素的部分性质如下:
CO(NH)2·H2O2。过氧化尿素的部分性质如下:
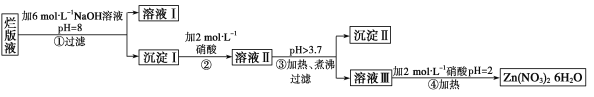
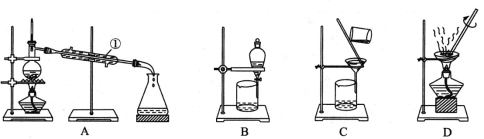
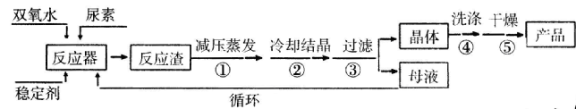
合成过氧化尿素的流程及反应装置图如下:
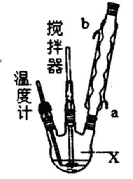
请回答下列问题:
(1)仪器X的名称是____________;冷凝管中冷却水从____________(填“a”或“b”)口进入。
(2)反应器的加热方式是_______________。
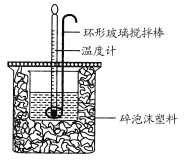
(3)搅拌器是否可用铁质材料___________(填“是”或“否”),原因是_______________。
(4)步骤① 采用减压蒸发的原因是___________。
(5)下列选项中,最适合作为步骤④ 的洗涤液是_______。
a.冰水 b.热水 c.饱和NaCl溶液 d.酒精和水的混合液
(6)准确称取0.5000g产品于250mL锥形瓶中,加适量蒸馏水溶解,再加1mL 6mol/L H2SO4,用0.1000 mol/L KMnO4标准溶液滴定至终点时消耗20.00mL(尿素与KMnO4溶液不反应)。
① 滴定终点的现象是______________。
② 则产品中CO(NH)2·H2O2的质量分数为______________。
③ 若滴定前仰视,滴定后俯视,则测得的过氧化尿素含量_________(填“偏高”、“偏低”或“不变”)。
【答案】(1)三颈烧瓶 a(2)水浴加热
(3)否 因为Fe与H2O2反应生成Fe3+,而Fe3+又促进H2O2分解
(4)过氧化尿素在温度高于45℃时会发生分解(5)a
(6)①溶液由无色变浅红色,且半分钟不褪色②94%③ 偏低
【解析】
试题分析:冷凝管水的流向是下进上出。因此是从a口进入。三颈烧瓶一般选择水浴加热的方法进行加热。此反应中搅拌器不能选择铁质材料,主要是Fe与H2O2反应生成Fe3+,而Fe3+又促进H2O2分解。从题中列出的表格可知过氧化尿素在温度高于45℃时会发生分解。因此步骤①要采用减压蒸发。高锰酸钾滴定过氧尿素,5H2O2 + 2 KMnO4 + 3H2SO4 =8H2O+2MnSO4 + K2SO4+ 5 O2可知2mol KMnO4(酸性)可以氧化5mol的H2O2,而题意中可知用了0.02×0.1=0.002 mol KMnO4,此时消耗H2O2的物质的量为(0.002×5)/2=0.005mol。即过氧尿素的物质的量为0.005mol;m=0.005×94=0.47g;则产品中CO(NH2)2H2O2的质量分数为0.47/0.5=94%;滴定前仰视,滴定后俯视,读数偏小,造成消耗高锰酸溶液读书偏小,消耗的CO(NH)2·H2O2的含量减少,结果偏低。