题目内容
11.下列有关叙述正确的是( )| A. | HF的稳定性很强,是因为其分子间能形成氢键 | |
| B. | 含有金属阳离子的晶体不一定是离子晶体 | |
| C. | 碘单质在水溶液中溶解度很小是因为I2和H2O都是非极性分子 | |
| D. | 对于组成和结构相似的分子晶体,一定是相对分子质量越大,熔沸点越高 |
分析 A、HF的稳定性很强,是由于H-F键键能较大的原因;
B、氯化铝是共价分子;
C、I2和是非极性分子而H2O是极性分子,非极性分子难溶于极性溶剂;
D、氢键影响分子晶体的熔沸点.
解答 解:A、HF的稳定性很强,是由于H-F键键能较大的原因,与氢键无关,故A错误;
B、氯化铝是共价分子,所以含有金属阳离子的晶体不一定是离子晶体,故B正确;
C、I2和是非极性分子而H2O是极性分子,非极性分子难溶于极性溶剂,相似相溶的所以碘单质在水溶液中溶解度很小,故C错误;
D、对于组成和结构相似的分子晶体,不一定是相对分子质量越大,熔沸点越高,氢键影响物质的熔沸点,如水的熔沸点大于硫化氢,故D错误;
故选B.
点评 本题考查了物质和化学键的关系,注意不能根据是否含有金属元素判断离子键,知道氢键对物质性质的影响,氢键不属于化学键,属于分子间作用力,为易错点.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
1.工业上利用CO和水蒸气在一定条件下发生反应制取氢气:
CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41kJ/mol
某小组研究在相同温度下该反应过程中的能量变化.他们分别在体积均为2L的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应.相关数据如下:
(1)该反应过程中,反应物分子化学键断裂时所吸收的总能量<(填“>”、“=”或“<”)生成物分子化学键形成时所释放的总能量;
(2)容器①中反应达平衡时,CO的转化率为80%;
(3)计算容器②中反应的平衡常数K=2;
(4)下列叙述正确的是ad(填字母序号);
a.平衡时,两容器中H2的体积分数相等
b.容器②中反应达平衡状态时,Q>65.6kJ
c.反应开始时,两容器中反应的化学反应速率相等
d.容器①中,反应的化学反应速率为:v(H2O)=0.4t1mol•L-1•min-1
(5)已知:2H2(g)+O2(g)═2H2O(g)△H=-484kJ/mol,写出CO完全燃烧生成CO2的热化学方程式:2CO(g)+O2(g)═2CO2(g)△H=-566KJ/mol.
CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41kJ/mol
某小组研究在相同温度下该反应过程中的能量变化.他们分别在体积均为2L的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应.相关数据如下:
| 容器编号 | 起始时各物质物质的量/mol | 达到平衡的时间/min | 达平衡时体系能量的变化/kJ | ||||
| CO | H2O | CO2 | H2 | ||||
| ① | 1 | 2.4 | 0 | 0 | t1 | 放出热量:32.8 kJ | |
| ② | 2 | 4.8 | 0 | 0 | t2 | 放出热量:Q | |
(2)容器①中反应达平衡时,CO的转化率为80%;
(3)计算容器②中反应的平衡常数K=2;
(4)下列叙述正确的是ad(填字母序号);
a.平衡时,两容器中H2的体积分数相等
b.容器②中反应达平衡状态时,Q>65.6kJ
c.反应开始时,两容器中反应的化学反应速率相等
d.容器①中,反应的化学反应速率为:v(H2O)=0.4t1mol•L-1•min-1
(5)已知:2H2(g)+O2(g)═2H2O(g)△H=-484kJ/mol,写出CO完全燃烧生成CO2的热化学方程式:2CO(g)+O2(g)═2CO2(g)△H=-566KJ/mol.
2.元素周期表中某区域的一些元素多用于制造半导体材料,它们是( )
| A. | 金属元素和非金属元素分界线附近的元素 | |
| B. | 右上方区域的非金属元素 | |
| C. | 过渡元素 | |
| D. | 稀有气体元素 |
19.下列关于SiO2和金刚石的叙述正确的是( )
| A. | SiO2晶体结构中,每个Si原子与2个O原子直接相连 | |
| B. | 通常状况下,60gSiO2晶体中含有的分子数为NA(NA表示阿伏加德罗常数) | |
| C. | 金刚石网状结构中,由共价键形成的碳原子环中,最小的环上有6个碳原子 | |
| D. | 1mol金刚石含4NAC-C键 |
6.下列各组物质反应后,再滴入KSCN溶液不显红色的是.( )
| A. | 铁锈与稀硫酸 | |
| B. | FeCl3和CuCl2的混合溶液与过量铁粉 | |
| C. | 过量Fe0与稀硝酸 | |
| D. | FeS04酸性溶液与KN03溶液 |
3.下列电离方程式中,正确的是( )
| A. | NaHCO3═Na++H++CO32- | B. | Ba(OH)2═Ba2++OH- | ||
| C. | Al2(SO4)3═2Al3++3SO42- | D. | NH3•H2O═NH4++OH- |
20.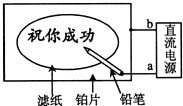 某学生设计了一个“黑笔写红字”的趣味实验.滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹.据此,下列叙述正确的是( )
某学生设计了一个“黑笔写红字”的趣味实验.滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹.据此,下列叙述正确的是( )
 某学生设计了一个“黑笔写红字”的趣味实验.滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹.据此,下列叙述正确的是( )
某学生设计了一个“黑笔写红字”的趣味实验.滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹.据此,下列叙述正确的是( )| A. | 铅笔端作阳极,发生还原反应 | B. | 铂片端作阳极,发生还原反应 | ||
| C. | 铅笔端有少量的氯气产生 | D. | a点是负极,b点是正极 |
1.含硅元素的物质有很多用途,下列说法不正确的是( )
| A. | 水玻璃是硅酸钠的水溶液,可用作木材防火剂的原料 | |
| B. | 化学家采用玛瑙研钵摩擦固体反应物进行无溶剂合成,玛瑙的主要成分是SiO2 | |
| C. | 我国的三峡大坝使用了大量水泥,水泥是硅酸盐材料 | |
| D. | 光导纤维主要成份为SiO2,可用作太阳能电池 |