��Ŀ����
����Ŀ����50mL 0.50 mol/L ��������50 mL 0.55mol/L������������Һʹ��ʹ������װ�ý����к��Ȳⶨʵ����
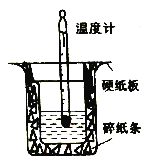
��1��װ����ȱ�ٵ�һ��������_____��װ���л����ڵĴ�����_______�����ִ�����������¶ȶ���_______������ƫ��������ƫС��������Ӱ����) ��
��2���ɷ�ȡ��55mL 0.50mol/L , NaOH ��Һ�ִ�50 mL 0.55m ѵL ������������Һ��____��������������������������
��3����ʵ��С����������ʵ�飬ÿ��ȡ��Һ��50mL������¼����ԭʼ������
ʵ����� | ���� ��ʼ�¶�t1/�� | ��ֹ�¶ȣ�t2���� | �²t2-t1���� | ||
���� | NaOH��Һ | ƽ��ֵ | |||
1 | 25.1 | 24.9 | 28.2 | ||
2 | 25.1 | 25.1 | 28.4 | ||
3 | 25.1 | 25.1 | 28.5 | ||
��֪���ᡢNaOH��Һ�ܶȽ���Ϊ1.0g/cm3���кͺ���Һ�ı����� C=4.2J/(g����)��ʽ��������÷�Ӧ���к���Ϊ��H=_____________________��������������С�����1λ��
���𰸡� ���β�������� ��С�ձ���δƽ�� ƫС ���� ![]() KJ/mol=-55.4KJ/mol
KJ/mol=-55.4KJ/mol
��������(1)װ����ȱ�ٵ�һ�������ǻ��β����������װ���л����ڵĴ����д�С�ձ���δƽ�룬���ִ�����������ɢʧ����������¶ȶ���ƫС��
(2)�к�����ʹ��������������أ�����ֻ�м����������HCl�����ʵ�����ȷ��������ȫ��Ӧ���ɣ��������55mL 0.50mol/L NaOH ��Һ����50 mL 0.55mol/L ������������Һ��
(3)��1��ʵ�鷴Ӧǰ���¶Ȳ�Ϊ��3.2�棻��2�η�Ӧǰ���¶Ȳ�Ϊ��3.3�棻��3��ʵ�鷴Ӧǰ���¶Ȳ�Ϊ��3.4�棬����Ч��ƽ��ֵΪ3.3�棬
0.55mol/L��NaOH��Һ50mL��0.50mol/L������50mL��������m=100mL��1g/mL=100g��c=4.2J/(g��)�����빫ʽQ=cm��T������0.025mol��ˮ�ų�����Q=4.2J/(g��)��100g��3.3��=1386J=1.386KJ��������0.025mol��ˮ�ų�����1.386KJ����������1mol��ˮ�ų�����Ϊ![]() =55.4kJ������ʵ���õ��к��ȡ�H=-55.4kJ/mol��
=55.4kJ������ʵ���õ��к��ȡ�H=-55.4kJ/mol��

 �¿α�������������ҵ�������γ�����ϵ�д�
�¿α�������������ҵ�������γ�����ϵ�д�