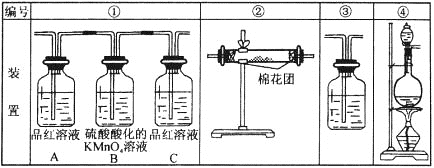
��Ŀ����
����Ŀ����ش��������⣺
��1����ˮ��T ��ʱpH��6�����¶���1 mol/L��NaOH��Һ�У���ˮ�������c(OH��)�� mol/L��
��2��ijһԪ������Һ(A)���Ԫǿ��(B)��pH��ȡ���������Һϡ����ͬ�ı�����pH(A) pH(B) (���������=������)����������ϡ����Һ�к͵�Ũ�ȵ������NaOH��Һ������ϡ����Һ�����V(A) V(B)(���������=������)��
��3����֪����Ԫ��H2R �ĵ��뷽��ʽ�ǣ�H2R=H++HR����HR��![]() R2��+H+����0.1molL��1NaHR��Һ��c(H+)=a molL��1����0.1molL��1H2R��Һ��c(H+) (0.1+a) molL��1(���������������=��)�������� ��
R2��+H+����0.1molL��1NaHR��Һ��c(H+)=a molL��1����0.1molL��1H2R��Һ��c(H+) (0.1+a) molL��1(���������������=��)�������� ��
��4������ƽ�ⳣ���Ǻ���������ʵ���̶ȵ�����������֪��
��ѧʽ | ���볣��(25 ��) |
HCN | K��4.9��10��10 |
CH3COOH[] | K��1.8��10��5 |
H2CO3 | K1��4.3��10��7��K2��5.6��10��11 |
��25 ��ʱ���е�Ũ�ȵ�HCN��Һ��H2CO3��Һ��CH3COOH��Һ������Һ��pH�ɴ�С��˳��Ϊ________(�û�ѧʽ��ʾ)��
����NaCN��Һ��ͨ��������CO2��������Ӧ�Ļ�ѧ����ʽΪ__________________��
���𰸡���1��10��12(2��)��2����(1��)��(1��)
��3����(1��)H2R�е�һ���������H+��HR���ĵ����������������(2��)
��4����H2CO3>HCN>CH3COOH(1��)��NaCN��H2O��CO2=HCN��NaHCO3(2��)
��������
���������
��1����ˮ��T ��ʱ��pH��6����c(H��)��c(OH��)��10��6����֪Kw��10��12��1 mol��L��1��NaOH��Һ����ˮ�������c(OH��)ȡ������Һ�е�c(H��)����c(OH��)ˮ������c(H��)��10��12 mol��L��1��
��2��ǿ��ÿϡ��10n����pH������n����λ������ÿϡ��10n����pH����n����λ����������Һϡ����ͬ�ı�����pH(A)<pH(B)��һԪ������Һ(A)���Ԫǿ��(B)��pH��ȣ�˵�������Ũ��Զ����ǿ���Ũ�ȣ�A�������ӵ����ʵ���Զ����B�������ӵ����ʵ���������������ϡ����Һ�к͵�Ũ�ȵ������NaOH��Һ������ϡ����Һ�����V(A) ��V(B)��
��3���ɶ�Ԫ��H2R �ĵ��뷽��ʽ�ǣ�H2R=H++HR-��HR-![]() R2- + H+����֪��0.1 mol��L-1NaHR��Һ��ֻ����HR-�ĵ��룬c(H+)=a mol��L-1����0.1mol��L-1H2R��Һ�д����������룬��һ���������H+��HR-�ĵ���������������ã�����c(H+)<(0.1+a) mol��L-1��
R2- + H+����֪��0.1 mol��L-1NaHR��Һ��ֻ����HR-�ĵ��룬c(H+)=a mol��L-1����0.1mol��L-1H2R��Һ�д����������룬��һ���������H+��HR-�ĵ���������������ã�����c(H+)<(0.1+a) mol��L-1��
��4��ǿ�������ζ�Ӧ���������Խ������ˮ��̶Ⱦ�Խ��pHԽ������ĵ���ƽ�ⳣ��ԽС������Na2CO3��Ӧ����K2��5.6��10��11��H2CO3��K1����K(HCN)��K2С��K(HCN)�������NaCN��Һ��ͨ��������CO2������Ӧ��NaHCO3��

����Ŀ����50mL 0.50 mol/L ��������50 mL 0.55mol/L������������Һʹ��ʹ������װ�ý����к��Ȳⶨʵ����

��1��װ����ȱ�ٵ�һ��������_____��װ���л����ڵĴ�����_______�����ִ�����������¶ȶ���_______������ƫ��������ƫС��������Ӱ����) ��
��2���ɷ�ȡ��55mL 0.50mol/L , NaOH ��Һ�ִ�50 mL 0.55m ѵL ������������Һ��____��������������������������
��3����ʵ��С����������ʵ�飬ÿ��ȡ��Һ��50mL������¼����ԭʼ������
ʵ����� | ���� ��ʼ�¶�t1/�� | ��ֹ�¶ȣ�t2���� | �²t2-t1���� | ||
���� | NaOH��Һ | ƽ��ֵ | |||
1 | 25.1 | 24.9 | 28.2 | ||
2 | 25.1 | 25.1 | 28.4 | ||
3 | 25.1 | 25.1 | 28.5 | ||
��֪���ᡢNaOH��Һ�ܶȽ���Ϊ1.0g/cm3���кͺ���Һ�ı����� C=4.2J/(g����)��ʽ��������÷�Ӧ���к���Ϊ��H=_____________________��������������С�����1λ��