题目内容
【题目】某小组为研究金属的腐蚀与防护,设计如图所示装置。下列叙述不正确的是:
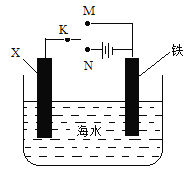
A.若X为碳棒,为减缓铁的腐蚀,开关K应置于N处
B.若X为碳棒,开关K置于M处,会加快铁的腐蚀
C.若X为锌,开关K置于M处,就是牺牲阳极的阴极保护法
D.若X为锌,开关K置于N处,铁电极发生的反应为Fe-2e- =Fe3+
【答案】D
【解析】
试题分析:A.若X为碳棒,为减缓铁的腐蚀,应该形成电解池,使铁为阴极,开关K应置于N处,A正确;B.若X为碳棒,开关K置于M处,就构成了原电池,由于电极活动性Fe>C,所以Fe为负极,发生反应:Fe-2e-=Fe2+,因此会加快铁的腐蚀,B正确;C.若X为锌,开关K置于M处,构成了原电池,由于电极活动性:Zn>Fe,所以Zn为负极,失去电子发生氧化反应,从而使铁得到保护,该方法就是牺牲阳极的阴极保护法,C正确;D. 若X为锌,开关K置于N处,构成电解池,铁电极发生的反应为O2+4e-+2H2O=4OH-,D错误。答案选D。

 新思维寒假作业系列答案
新思维寒假作业系列答案【题目】用50mL 0.50 mol/L 的盐酸与50 mL 0.55mol/L的氢氧化钠溶液使用使用如下装置进行中和热测定实验。

(1)装置中缺少的一种仪器是_____,装置中还存在的错误有_______,这种错误会造成最高温度读教_______(填“偏大”、“偏小”或“无影响”) 。
(2)可否取用55mL 0.50mol/L , NaOH 溶液种代50 mL 0.55m 训L 的氢氧化钠溶液?____(填“可用”或“不可以”)
(3)该实验小组做了三次实验,每次取溶液各50mL,并记录如下原始数据。
实验序号 | 起始温度t1/℃ | 终止温度(t2)℃ | 温差(t2-t1)℃ | ||
盐酸 | NaOH溶液 | 平均值 | |||
1 | 25.1 | 24.9 | 28.2 | ||
2 | 25.1 | 25.1 | 28.4 | ||
3 | 25.1 | 25.1 | 28.5 | ||
已知盐酸、NaOH溶液密度近似为1.0g/cm3,中和后混和液的比热容 C=4.2J/(g·℃)列式并计算则该反应的中和热为△H=_____________________;(计算结果保留小数点后1位)
【题目】为了探究化学反应速率和化学反应限度的有关问题,某研究小组进行了以下实验:
序号 | 反应温度/℃ | C(H2O2)/mol-L | V(H2O2)/mL | M(MnO2)/g | t/min |
1 | 20 | 2 | 10 | 0 | t1 |
2 | 20 | 2 | 10 | 0.1 | t2 |
3 | 20 | 4 | 10 | 0.1 | t3 |
4 | 40 | 2 | 10 | 0.1 | t4 |
(1)设计实验2和实验3的目的是研究_______对化学反应速率的影响。
(2)为研究温度对化学反应速率的影响,可以将实验_____和实验____作对比(填序号)。
(3)将实验1和实验2作对比,t1____t2(填“>”、“<”或“=”)。
II.以KI和FeCl3反应为例(2Fe3++2I-![]() 2Fe2++I2)设计实验,探究此反应存在一定的限度。可选试剂:①0.1mol·L-1KI溶液 ②0.1mol·L-1 FeCl3溶液③0.1mol·L-1 FeCl2溶液 ④0.1mol·L-1 HCl溶液⑤0.1mol·L-1 FeSCN溶液⑥ CCl4
2Fe2++I2)设计实验,探究此反应存在一定的限度。可选试剂:①0.1mol·L-1KI溶液 ②0.1mol·L-1 FeCl3溶液③0.1mol·L-1 FeCl2溶液 ④0.1mol·L-1 HCl溶液⑤0.1mol·L-1 FeSCN溶液⑥ CCl4
实验步骤:
(1)取5mL0.1mol·L-1KI溶液,再滴加几滴0.1mol·L-1 FeCl3溶液
(2)充分反应后,将溶液分成三份;
(3)取其中一份,加试剂⑥,振荡,CCl4层显紫色,说明反应生成碘;
(4)另取一份,加试剂_______(填序号),现象___________,说明此反应存在一定的限度。