题目内容
由一种阳离子与两种酸根离子组成的盐称为混盐。混盐CaOCl2在酸性条件下可以产生氯气。该混盐 ( )
| A.水溶液呈中性 |
| B.与硫酸反应产生1mol氯气时转移2mol电子 |
| C.水溶液不能使淀粉-KI试纸变蓝 |
| D.既含离子键又含共价键 |
D
解析试题分析:混盐CaOCl2是由CaCl2与Ca(ClO)2组成的。CaCl2是强酸强碱盐,水溶液显中性,但是Ca(ClO)2是强碱弱酸盐,水解使水溶液显碱性。错误。B.与硫酸反应:CaOCl2+H2SO4=CaSO4+Cl2↑+H2O. 产生1mol氯气时转移1mol电子.错误。C.水溶液含有ClO-,该离子有强氧化性,能把I-氧化为I2,所以能使淀粉-KI试纸变蓝。错误。D.该盐是离子化合物,含有离子键。在ClO-中含有极性共价键,因此该化合物既含离子键又含共价键。正确。
考点:考查混盐CaOCl2的性质。

练习册系列答案
 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案
相关题目
工业废水中常含有一定量的Cr2O72—和CrO42—,它们会对人类及生态系统产生很大的危害,必须进行处理。下面是一种处理方法的工业流程: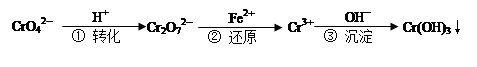
下列说法正确的是:
| A.改变反应①的平衡体系中c(H+)浓度,溶液颜色无明显变化 |
| B.若2v (Cr2O72—) ="v" (CrO42—),说明反应①达平衡状态 |
| C.反应②中还原1mol Cr2O72—,需要6 mol的Fe2+ |
D.FeSO4溶液呈酸性的原因是Fe2++ 2H2O  Fe(OH) 2↓+ 2H+ Fe(OH) 2↓+ 2H+ |
下图是一种综合处理SO2废气的工艺流程。下列说法正确的是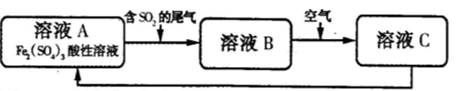
| A.向B溶液中滴加KSCN溶液,溶液变为血红色 |
| B.溶液B转化为溶液C发生的变化的离子方程式为4H++2Fe2++O2=2Fe3++2H2O |
| C.溶液酸性A>B>C |
| D.加氧化亚铁可以使溶液C转化为溶液A |
氧化还原反应与四种基本反应类型的关系如图所示,则下列化学反应属于阴影部分的是 ( )。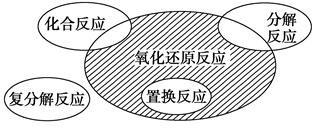
| A.Cl2+2KBr=Br2+2KCl |
B.2NaHCO3 Na2CO3+H2O+CO2↑ Na2CO3+H2O+CO2↑ |
| C.4Fe(OH)2+O2+2H2O=4Fe(OH)3 |
| D.2Na2O2+2CO2=2Na2CO3+O2 |
下列物质分别与水发生反应:①Na、②NaH、③NO2、④Cl2、⑤SO3、
⑥Na2O2,其中属于氧化还原反应,但水既不是氧化剂又不是还原剂的是( )
| A.①③⑥ | B.②⑤ | C.③④⑥ | D.④⑤⑥ |
把7.2 g铁粉投入某硝酸溶液中,充分反应剩余固体1.6 g,产生NO2和NO的混合气体0.08 mol。若不考虑N2O4的存在,则原HNO3溶液中HNO3的物质的量为( )
| A.0.34 mol | B.0.38 mol |
| C.0.28 mol | D.0.2 mol |
氯酸是一种强酸,浓度超过40%时会发生分解,反应可表示为:aHClO3=bO2↑+cCl2↑+dHClO4+eH2O,下列说法正确的是( )
| A.由反应可知,氧气、氯气均为氧化产物 |
| B.若化学计量数a=8,则该反应转移电子数为12e- |
| C.若b确定,则方程式中其他物质的化学计量数均能确定 |
| D.若氯酸分解所得混合气体,1 mol混合气体质量为51.5 g,则反应方程式可表示为:5HClO3=O2↑+Cl2↑+3HClO4+H2O |
根据表中信息,判断下列叙述中正确的是 ( )。
| 序号 | 氧化剂 | 还原剂 | 其他反应物 | 氧化产物 | 还原产物 |
| ① | Cl2 | FeBr2 | / | Fe3+、Br2 | |
| ② | KClO3 | 浓盐酸 | / | Cl2 | |
| ③ | KMnO4 | H2O2 | H2SO4 | O2 | Mn2+ |
A.由表中①组的信息可知通入Cl2的量不同,氧化产物可能不同
B.氧化性强弱的比较:KClO3>Fe3+>Cl2>Br2
C.表中②组反应的还原产物是KCl,电子转移数目是6e-
D.表中③组反应的离子方程式为2MnO4—+3H2O2+6H+=2Mn2++4O2↑+6H2O
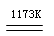 aTiCl4+cCO……反应①
aTiCl4+cCO……反应① Ti+2MgCl2……反应②
Ti+2MgCl2……反应②