题目内容
【题目】某探究小组用盐酸与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用HCl浓度为1.00mol/L、2.50mol/L,大理石有细颗粒和粗颗粒两种规格,实验温度为25℃、40℃,每次实验盐酸的用量为25.00mL,大理石用量为10.00g。
(1)写出盐酸与大理石反应的化学方程式________
(2)请完成以下实验设计表,并把实验中空缺处补充完整:
实验 编号 | 温度 (℃) | 大理石 规格 | HCl浓度(mol/L) | 实验目的 |
① | 25 | 粗颗粒 | 2.50 | (I)实验①和②探究温度对反应速率的影响; (II)实验①和③探究浓度对反应速率的影响; (III)实验①和④探究______对反应速率的影响 |
② | __ | 粗颗粒 | 2.50 | |
③ | 25 | 粗颗粒 | ___ | |
④ | 25 | 细颗粒 | 2.50 |
(3)实验①中CO2质量随时间变化的关系见下图。计算实验①中70s-90s范围内用HCl表示的平均反应速率 ______(忽略溶液体积变化)

【答案】CaCO3+2HCl=CaCl2+H2 O+CO2↑ 40 1.00 固体物质的表面积(答接触面亦可) 0.01mol/(L·s)
【解析】
(1)根据化学反应原理写出盐酸与大理石反应的化学方程式;
(2) 实验①和②探究温度对反应速率的影响,应该温度不同;
实验①和③探究浓度对反应速率的影响,应该盐酸的浓度不同;
实验①和④所用大理石的规格不同,探究固体表面积大小对反应速率的影响,;
(3) 先根据图象,求出生成二氧化碳的物质的量,然后根据反应:CaCO3 +2HCl═CaCl2 +H2O+CO2↑,求出消耗的HCl的物质的量,再由υ (HCl) =![]() 求出反应速率。
求出反应速率。
(1)根据实验室制取二氧化碳的反应原理,大理石与稀盐酸反应的化学方程式为:CaCO3 +2HCl═CaCl2 +H2O+CO2↑;
(2)②、由于实验①和②探究温度对反应速率的影响,故温度不同,应该选40℃,故答案为:40;
③、实验①和③探究浓度对反应速率的影响,故盐酸的浓度不同,应该是1.00mol/L,故答案为:1.00
④、实验①和④的大理石规格不同,探究的是固体物质的表面积对反应速率的影响,故答案为:固体物质的表面积;
(3) 由图可知70至90s,CO2生成的质量为m (CO2) =0.95g-0. 84g=0.11g,物质的量为n (CO2) =![]() =0.0025mol,根据反应CaCO3 +2HCl═CaCl2 +H2O+CO2↑,可知消耗HCl的物质的量为n (HCl) =2×0.0025mol=0. 005mol,又溶液体积为25mL=0.025L,所以HCl减少的浓度△c (HCl) =
=0.0025mol,根据反应CaCO3 +2HCl═CaCl2 +H2O+CO2↑,可知消耗HCl的物质的量为n (HCl) =2×0.0025mol=0. 005mol,又溶液体积为25mL=0.025L,所以HCl减少的浓度△c (HCl) =![]() =0.2mol/L;反应的时间t=90s-70s=20s,所以HCl在70-90s范围内的平均反应速率为υ (HCl) =
=0.2mol/L;反应的时间t=90s-70s=20s,所以HCl在70-90s范围内的平均反应速率为υ (HCl) =![]() =
=![]() =0.01mol/(L·s)。
=0.01mol/(L·s)。

【题目】乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味。实验室制备乙酸异戊酯的反应、装置示意图和有关数据如下:
相对分子质量 | 密度/(gcm-3) | 沸点/℃ | 水中溶解性 | |
异戊醇 | 88 | 0.8123 | 131 | 微溶 |
乙酸 | 60 | 1.0492 | 118 | 溶 |
乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 |
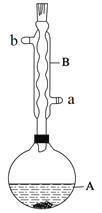
实验步骤:
在A中加入4.4 g异戊醇(3-甲基-1-丁醇)、6.0 g乙酸、数滴浓硫酸和2~3片碎瓷片。开始缓慢加热A,回流50 min。反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液和水洗涤;分出的产物加入少量无水MgSO4固体,静置片刻,过滤除去MgSO4固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯3.9 g。
回答下列问题:
(1)仪器B的具体名称是____________,实验时冷却水的进水口是_____(a或b)。
(2)在洗涤操作中,先水洗再饱和NaHCO3溶液洗而不是直接用饱和NaHCO3溶液洗涤的原因是____________________。
(3)该制备反应的化学反应方程式为__________________________。
(4)本实验中加入过量乙酸的目的是___________________________。
(5)本实验中不能用生石灰代替无水MgSO4的原因________________________。
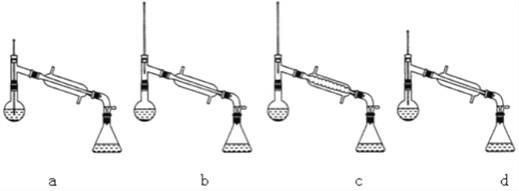
(6)在蒸馏操作中,仪器选择及安装都正确的是___________(填标号)。
(7)本实验的产率是___________________________



