��Ŀ����
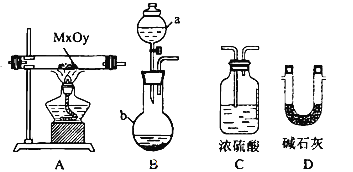
����Ŀ�����Ȼ�ͭ���壨CuCl22H2O���к���FeCl2���ʣ�Ϊ�Ƶô������Ȼ�ͭ���壬���Ƚ�������ˮ��������������Ƴ�ˮ��Һ��Ȼ����ͼ��ʾ�IJ�����������ᴿ��
��֪�����£����и����ʵ�KSP��
���� | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
Ksp(25 ��) | 8.0��10��16 | 2��10��20 | 4.0��10��38 |
��1���������ʶ�������Ϊ���������������ʺϱ�ʵ����� ��
A��H2O2 B��KMnO4 C��HNO3 D��K2Cr2O7
д������ѡ�õ��������ڸ�ʵ���еķ�����Ӧ�����ӷ���ʽ�� ��
��2������Y�� ������E�Ļ�ѧʽ ��
��3������Һ�õ�������CuCl22H2O����Ӧ���õķ����� �����ˡ�ϴ�ӡ�
��4���������Y֮��Cu2+��Ũ��Ϊ0.02 mol/L��Ҫʹ Cu2+��ˮ�⣬�����Y����Һ��pH���ܳ��� ��
���𰸡���1��A��2Fe2++H2O2+2H+=2Fe3++2H2O��
��2��CuO��Cu(OH)2����CuCO3����Fe(OH)3
��3���������ᣬ����Ũ������ȴ�ᾧ�������Ȼ�������������Ũ������ȴ�ᾧ��
��4��5
��������
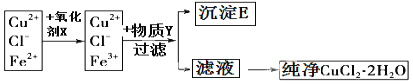
�����������ȡ����Ϊ�������������ӵ���Һ�м���������X�����������������������ӣ�Ȼ�����Y������Һ��pH��ʹ��������ȫת�����������������������Y���������µ����ʣ�����Y����ΪCuO��Cu(OH)2��CuCO3����ȥ���ʺ����ҺΪ�Ȼ�ͭ��Һ������Һ��HCl�������е��¼����������õ��Ȼ�ͭ���壬
��1����������ṩ��Ϣ��֪Fe3+���������pH��С������Ӧ�Ƚ�Fe2+����ΪFe3+���ٽ����ȥ�����ݿ�ͼ������������X�ɰ�Fe2+����ΪFe3+����û�����������ʣ�����X����ΪH2O2��B������K+��Mn2+��C���������������ӣ�D����������ӡ������ӡ�������Ӧ���ӷ���ʽΪ��2Fe2++H2O2+2H+=2Fe3++2H2O��
�ʴ�Ϊ��A��2Fe2++H2O2+2H+=2Fe3++2H2O��
��2�������ʾ������pH4��5��ʹFe3+ȫ��������ͬ�������������ʣ�����Y���ΪCuO��Cu(OH)2��CuCO3����ȥFe3+���й����ӷ���ʽFe3++3H2OFe(OH)3+3H+��CuO+2H+�TCu2++H2O����ʹ�����������ɳ����ķ����ƶ���
�ʴ�Ϊ��CuO��Cu(OH)2����CuCO3����Fe(OH)3��
��3��CuCl2����ǿ�������Σ���������ʱ�ٽ���ˮ�⣨HCl�ӷ���������Ӧ�������ᣬ����Ũ������ȴ�ᾧ�������Ȼ�������������Ũ������ȴ�ᾧ�������ˡ�ϴ�ӵȵķ������õ�CuCl22H2O�ľ��塣
�ʴ�Ϊ���������ᣬ����Ũ������ȴ�ᾧ�������Ȼ�������������Ũ������ȴ�ᾧ����
��4���������֪��Cu(OH)2��Ksp=2.0��10-20����ʱ[c(OH-)]2=2.0��10-20/0.02=1��10-18��c(OH-)=1��10-9��c(H+)=1��10-5������ҺpH=5��Ҫʹ Cu2+��ˮ�⣬�����Y����Һ��pH���ܳ���5��
�ʴ�Ϊ��5��

 �¿α�������������ҵ�������γ�����ϵ�д�
�¿α�������������ҵ�������γ�����ϵ�д�