��Ŀ����
����Ŀ�����ܵĴ洢������Ӧ�õ���Ҫƿ������λ�⻯��������廯������Ŀǰ�����õ���Ҫ������ϡ�
��1��Ti��BH4��2��һ�ֹ���Ԫ�����⻯�ﴢ����ϡ���̬Tiԭ�ӵ���ռ�ݵ�����ܲ�����________����̬Ti2+���۵����ĵ����Ų�ʽ ��
��2��Һ���Ǹ������ʣ������ܵ��������壬����N2+3H22NH3ʵ�ִ�������⣮����˵����ȷ����_________������ţ���
a��NH3�����е�ԭ�ӵĹ���ӻ���ʽΪsp2�ӻ�
b��NH4+��C1O4-��PH4+��CH4��BH4-��Ϊ�ȵ�����
c����ͬѹǿʱ��NH3�ķе��PH3�ķе��
d���縺��C<N<O , ��һ������C< O < N
��3��Se��Oͬ�壬�� SeO2���ӵĿռ乹��Ϊ
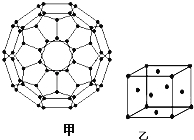
��4������ϩ��C60���Ľṹ��ͼ�ף�������̼ԭ�ӹ�����ӻ�����Ϊ ��1mol C60�����ЦҼ�����ĿΪ ����
��5��ͼ��Ϊһ������ͭ�ľ������˾���������ı߳�Ϊa pm��Cu�����ԭ������Ϊ64������ͭ���ܶ�Ϊ�� g/cm3�����ӵ������ɱ�ʾΪ mol��1���ú�a���ѵĴ���ʽ��ʾ����
���𰸡���1��N��3d2
��2��cd
��3��V����
��4��sp2��90NA
��5��(2.56��1032)/��a3
��������
�����������1��Ti��ԭ������Ϊ22��������Ų�ʽΪ��1s22s22p63s23p63d24s2�����ԣ�Ti����ܲ�ΪN�㣬��̬Ti2+�۵����Ų�ʽΪ��3d2���ʴ�Ϊ��N��3d2��
��2��a��NH3������Nԭ�Ӻ���3�����õ��ӶԺ�һ���µ��Ӷԣ�������۲���Ӷ���4������sp3�ӻ�����A����b���ȵ�����Ϊԭ������Ⱥͼ۵�������ȵ�ԭ���ţ�NH+4��PH+4��CH4��BH-4������5��ԭ���ţ��Ҽ۵��Ӿ�Ϊ8��Ϊ�ȵ����壬��ClO-4�۵�����Ϊ32�������ڵȵ����壬��B����c�����Ӽ����������۷е�ߣ���ͬѹǿʱ�������к��������PH3�в������������NH3�е��PH3�ߣ���C��ȷ��d���縺��C<N<O �� ��һ������C< O < N����D��ȷ���ʴ�Ϊ��cd��
��3���������������м۲���Ӷ�=2+1/2��6-2��2��=3���Һ���һ���µ��Ӷԣ���������V�Ρ��ʴ�Ϊ��V�Σ�
��4��ÿ��̼ԭ�Ӻ��еĦҼ������Ҳ����µ��Ӷԣ����Բ���sp2 �ӻ���ÿ��̼ԭ�Ӻ��еĦҼ�����Ϊ3/2������1molC60�����ЦҼ�����Ŀ=3/2��60NA=90NA���ʴ�Ϊ��sp2��90NA��
��5�������к���ͭԭ����Ŀ=8��1/8+6��1/2=4��������Ϊ4��64��NAg���þ������Ϊa3cm3����4��64��NAg=a3cm3����g/cm3����NA=(2.56��1032)/��a3���ʴ�Ϊ��(2.56��1032)/��a3��

����Ŀ�����Ȼ�ͭ���壨CuCl22H2O���к���FeCl2���ʣ�Ϊ�Ƶô������Ȼ�ͭ���壬���Ƚ�������ˮ��������������Ƴ�ˮ��Һ��Ȼ����ͼ��ʾ�IJ�����������ᴿ��
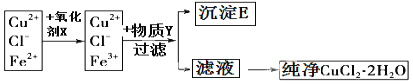
��֪�����£����и����ʵ�KSP��
���� | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
Ksp(25 ��) | 8.0��10��16 | 2��10��20 | 4.0��10��38 |
��1���������ʶ�������Ϊ���������������ʺϱ�ʵ����� ��
A��H2O2 B��KMnO4 C��HNO3 D��K2Cr2O7
д������ѡ�õ��������ڸ�ʵ���еķ�����Ӧ�����ӷ���ʽ�� ��
��2������Y�� ������E�Ļ�ѧʽ ��
��3������Һ�õ�������CuCl22H2O����Ӧ���õķ����� �����ˡ�ϴ�ӡ�
��4���������Y֮��Cu2+��Ũ��Ϊ0.02 mol/L��Ҫʹ Cu2+��ˮ�⣬�����Y����Һ��pH���ܳ��� ��
