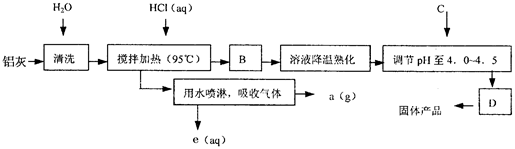
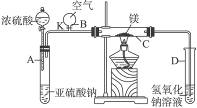
题目内容
有2 g镁铝合金,与足量的HCl反应,生成气体2.24 L,求该合金中镁、铝的质量百分比。
镁、铝的质量比为2∶3
本题可以按常规方法设未知数列方程求解,也可由十字交叉法。
用十字交叉法求解:
由2.4 g Mg可生成2.24 L H2,1.8 g Al可生成2.24 L H2,合金2 g生成2.24 L H2得:
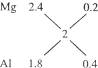
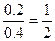
所以m(Mg)∶m(Al)=(1×2.4)∶(2×1.8)=2∶3
特别注意:1∶2不是n(Mg)∶n(Al),而是质量为2.4 g的Mg和质量为1.8 g的Al的份数比。
用十字交叉法求解:
由2.4 g Mg可生成2.24 L H2,1.8 g Al可生成2.24 L H2,合金2 g生成2.24 L H2得:

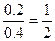
所以m(Mg)∶m(Al)=(1×2.4)∶(2×1.8)=2∶3
特别注意:1∶2不是n(Mg)∶n(Al),而是质量为2.4 g的Mg和质量为1.8 g的Al的份数比。

练习册系列答案
相关题目