题目内容
下列说法错误的是;
| A.某雨水样品采集后放置一段时间,pH由4.68变为4.28,是因为水中溶解了较多的CO2 |
| B.硅酸盐NaAlSiO4·nH2O可改写成氧化物形式为:Na2O·Al2O3·2SiO2·2nH2O |
| C.Al65Cu23Fe12是一种拟晶,具有合金的优良物理性能,其硬度比金属Al、Cu、Fe都大 |
| D.过量铁与浓硫酸加热反应可以得到氢气 |
A
试题分析:A.某雨水样品采集后放置一段时间,pH由4.68变为4.28,是因为水中溶解了较多的SO2,发生反应:2SO2+2H2O+ O2=2H2SO4;由弱酸变为强酸,溶液中H+浓度增大,所以pH减小。错误。B.硅酸盐既可以用盐的形式表示,也可以用氧化物的形式表示。在用不同的形式表示时,各种元素的原子个数比相同。因此NaAlSiO4·nH2O也可改写成氧化物形式为:Na2O·Al2O3·2SiO2·2nH2O。正确。C. Al65Cu23Fe12是一种拟晶,具有合金的优良物理性能,合金具有许多优良的性能,如硬度比成分金属大,熔沸点比成分金属低等。故其硬度比金属Al、Cu、Fe都大。正确。D.铁与浓硫酸加热反应得到硫酸铁、二氧化硫和水,产生的硫酸铁与过量的Fe发生反应得到硫酸亚铁。随着反应的进行,硫酸变为稀硫酸,则是Fe与稀硫酸反应得到硫酸亚铁和氢气。因此最终可以得到氢气。正确。

练习册系列答案
相关题目
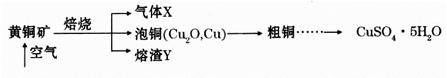


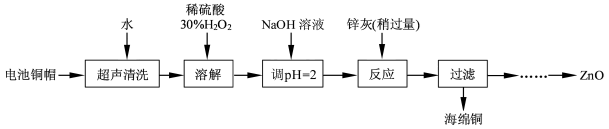
 滴定剂EDTA(H2Y2-)标准溶液滴定至终点(滴定剂不与杂质反应),消耗滴定剂b mL。滴定反应如下:
滴定剂EDTA(H2Y2-)标准溶液滴定至终点(滴定剂不与杂质反应),消耗滴定剂b mL。滴定反应如下: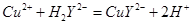 。则CuSO4·5H2O质量分数为__________。滴定管用蒸馏水洗涤后,直接注入标准溶液,则会导致测定结果偏_______。
。则CuSO4·5H2O质量分数为__________。滴定管用蒸馏水洗涤后,直接注入标准溶液,则会导致测定结果偏_______。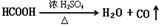 原理,用下列仪器(加热及固定装置省略)制备干燥、纯净的CO,并用CO还原CuO粉末。
原理,用下列仪器(加热及固定装置省略)制备干燥、纯净的CO,并用CO还原CuO粉末。
 2 Cu2O + O2↑;③ Cu2O +2H+
2 Cu2O + O2↑;③ Cu2O +2H+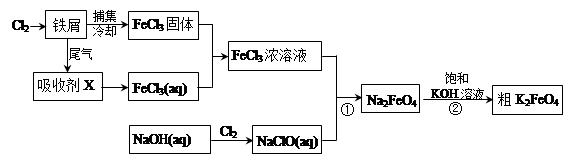
 K2FeO4+2NaOH,请根据相关反应原理分析反应能发生的原因 。
K2FeO4+2NaOH,请根据相关反应原理分析反应能发生的原因 。