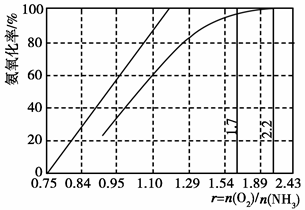
题目内容
在一定量的Fe、FeO、Fe2O3的混合物中,加入100mL、1.1mol/L的盐酸反应并放出标准状况下224mL气体,反应后溶液中阳离子只有Fe2+、H+,且溶液的pH=1(不考虑盐的水解及溶液体积的变化)。则反应后溶液Fe2+的物质的量浓度(mol·L-1)为
| A.0.05 | B.0.5 | C.0.55 | D.1.1 |
B
试题分析:在一定量的Fe、FeO、Fe2O3的混合物中,加入100mL1.1mol/L的盐酸反应并放出标准状况下224mL气体,反应后溶液中阳离子只有Fe2+、H+,且溶液的pH=1,则反应后溶液为氯化亚铁和盐酸的混合液,根据题意及电荷守恒知,2c(Fe2+)+c(H+)=c(Cl-)。即2c(Fe2+)+0.1mol/L=1.1mol/L ,则反应后溶液Fe2+的物质的量浓度为0.5mol·L-1,选B。

练习册系列答案
相关题目

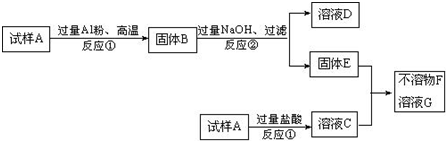
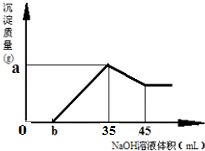
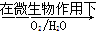 Fe2++SO42-
Fe2++SO42-