题目内容
氯化铁和高铁酸钾都是常见的水处理剂。下图为制备氯化铁及进一步氧化制备高铁酸钾的工艺流程。
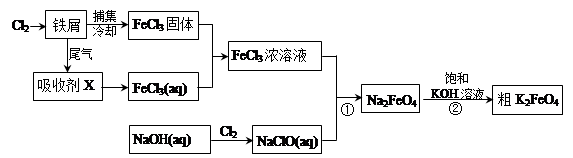
请回答下列问题:
(1)氯化铁有多种用途:
①氯化铁做净水剂。请用离子方程式表示其原理____________ __________;
②工业上常用FeCl3溶液腐蚀铜印刷线路板。这是利用了FeCl3较强的__________性。
(2)吸收剂X的化学式为 。为检验吸收剂是否已完全转化为FeCl3溶液,有人设计用酸性高锰酸钾溶液,但很快被否定,理由是(用离子方程式表示) 。正确的检验方法是:取少量待测液,加入 (写化学式)溶液,若无深蓝色沉淀产生,则证明转化完全。
(3)碱性条件下反应①的离子方程式为____________________________________。
(4)过程②将混合溶液搅拌半小时,静置,抽滤获得粗产品。该反应的化学方程式为2KOH+Na2FeO4 K2FeO4+2NaOH,请根据相关反应原理分析反应能发生的原因 。
K2FeO4+2NaOH,请根据相关反应原理分析反应能发生的原因 。
(5)将粗K2FeO4产品经重结晶、过滤、 、 ,即得较纯净的K2FeO4。
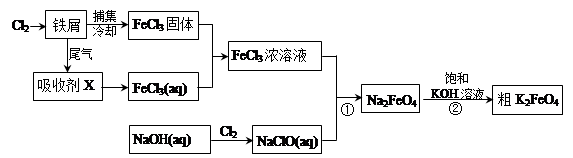
请回答下列问题:
(1)氯化铁有多种用途:
①氯化铁做净水剂。请用离子方程式表示其原理____________ __________;
②工业上常用FeCl3溶液腐蚀铜印刷线路板。这是利用了FeCl3较强的__________性。
(2)吸收剂X的化学式为 。为检验吸收剂是否已完全转化为FeCl3溶液,有人设计用酸性高锰酸钾溶液,但很快被否定,理由是(用离子方程式表示) 。正确的检验方法是:取少量待测液,加入 (写化学式)溶液,若无深蓝色沉淀产生,则证明转化完全。
(3)碱性条件下反应①的离子方程式为____________________________________。
(4)过程②将混合溶液搅拌半小时,静置,抽滤获得粗产品。该反应的化学方程式为2KOH+Na2FeO4
 K2FeO4+2NaOH,请根据相关反应原理分析反应能发生的原因 。
K2FeO4+2NaOH,请根据相关反应原理分析反应能发生的原因 。(5)将粗K2FeO4产品经重结晶、过滤、 、 ,即得较纯净的K2FeO4。
(1)①Fe3++3H2O
 Fe(OH)3 (胶体) + 3H+ ②氧化
Fe(OH)3 (胶体) + 3H+ ②氧化
(2)FeCl2 10Cl-+2MnO4-+16H+=5Cl2↑+2Mn2++ H2O 铁氰化钾或K3[Fe(CN)6] (写成K3Fe(CN)6也可)
(3)3ClO-+2Fe3++10OH-==2FeO42-+3Cl-+5H2O
(4)K2FeO4的溶解度比Na2FeO4小而溶液中K+、FeO42-的浓度比较大(合理答案均计分)
(5)洗涤、干燥

 Fe(OH)3 (胶体) + 3H+ ②氧化
Fe(OH)3 (胶体) + 3H+ ②氧化(2)FeCl2 10Cl-+2MnO4-+16H+=5Cl2↑+2Mn2++ H2O 铁氰化钾或K3[Fe(CN)6] (写成K3Fe(CN)6也可)
(3)3ClO-+2Fe3++10OH-==2FeO42-+3Cl-+5H2O
(4)K2FeO4的溶解度比Na2FeO4小而溶液中K+、FeO42-的浓度比较大(合理答案均计分)
(5)洗涤、干燥
试题分析:(1)①氯化铁做净水剂是因为Fe3+水为Fe(OH)3胶体的缘故;②工业上常用FeCl3溶液腐蚀铜印刷线路板。是Fe3+氧化了Cu的缘故,FeCl3较强的氧化性。
(2)吸收剂X的与Cl2反应的产物是FeCl3,X是FeCl2。为检验吸收剂是否已完全转化为FeCl3溶液,用酸性高锰酸钾溶液不能验证,因为Cl-能被酸性高锰酸钾氧化为Cl2。Fe2+与铁氰化钾溶液或深蓝色沉淀产生,可用此显色反应来验证是否存在Fe2+。
(3)碱性条件下根据反应物和产物可知,反应①的离子方程式为3ClO-+2Fe3++10OH-==2FeO42-+ 3Cl-+5H2O。
(4)过程②将混合溶液搅拌半小时,静置,抽滤获得粗产品。该反应的化学方程式为2KOH+Na2FeO4
 K2FeO4+2NaOH,请根据相关反应原理分析反应能发生的原因K2FeO4的溶解度比Na2FeO4小而溶液中K+、FeO42-的浓度比较大。
K2FeO4+2NaOH,请根据相关反应原理分析反应能发生的原因K2FeO4的溶解度比Na2FeO4小而溶液中K+、FeO42-的浓度比较大。(5)将粗K2FeO4产品经重结晶、过滤、洗涤、干燥,即得较纯净的K2FeO4。2+、Fe3+、K2FeO4之间的转化及其各自的性质、鉴别方法。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目


 Fe2++SO42-
Fe2++SO42-