题目内容
【题目】将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀的物质的量与所通入CO2的体积关系如图所示。下列关于整个反应过程中的说法错误的是( )
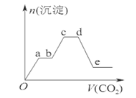
A. e点溶液中c(HCO3-)>c(K+)
B. bc段反应的离子方程式是AlO2-+2H2O+CO2=Al(OH)3↓+HCO3-
C. d点溶液中c(K+)= c(H2CO3)+c(HCO3-)+c(CO32-)
D. Oa段与de段所消耗CO2的体积相同
【答案】B
【解析】
在各个阶段发生的反应是:O~a:Ba(OH)2+CO2=BaCO3↓+H2O;
a~b段:2KOH+CO2=K2CO3+H2O;
b~c:2AlO2-+3H2O+CO2=2Al(OH)3↓+CO32-;
c~d段:K2CO3+H2O+CO2=2KHCO3;
d~e段:BaCO3+H2O+CO2=Ba(HCO3)2,沉淀部分溶解;
据此分析。
只要通入CO2,立刻就有沉淀BaCO3产生,首先发生反应Ba(OH)2+CO2=BaCO3↓+H2O,将Ba(OH)2消耗完毕,接下来消耗KOH,发生反应2KOH+CO2=K2CO3+H2O,因而此段沉淀的量保持不变,然后沉淀量增大,发生反应2AlO2-+3H2O+CO2=2Al(OH)3↓+CO32-,沉淀量达最大后,再发生K2CO3+H2O+CO2=2KHCO3,最后发生反应BaCO3+H2O+CO2=Ba(HCO3)2,沉淀部分溶解。
A、根据反应c~d段:K2CO3+H2O+CO2=2KHCO3;d~e段:BaCO3+H2O+CO2=Ba(HCO3)2,故e点溶液中c(HCO3-)>c(K+),选项A正确;
B、b~c段反应的离子方程式是:2AlO2-+3H2O+CO2=2Al(OH)3↓+CO32-,选项B错误;
C、d点为KHCO3溶液,根据物料守恒有c(K+)= c(H2CO3)+c(HCO3-)+c(CO32-),选项C正确;
D、由上述分析可知,Oa发生反应为:Ba(OH)2+CO2=BaCO3↓+H2O,de段发生反应BaCO3+H2O+CO2=Ba(HCO3)2,根据反应可知,消耗CO2的体积相同,选项D正确;
答案选B。