题目内容
【题目】铁和铝是两种重要的金属,它们的单质及其化合物有着各自的性质。
(1)将已配制好的溶液滴入沸水中并煮沸一段时间,可得到红褐色液体,该反应的离子方程式为:________________,此液体具有的性质是_________
a.光束通过该液体时形成光亮的“通路”
b.向该液体中加入AgNO3溶液,无沉淀产生
c.该液体能发生电泳现象,阴极附近颜色变深
d.将该液体加热、蒸干、灼烧后,有氧化物生成
(2)印刷电路板是由高分子材料和铜箔复合而成,刻制印刷电路时,要用FeC13溶液作为“腐蚀液”,请写出该反应的化学方程式_______________________________。
(3)某氧化铝样品中含有氧化铁、氧化亚铁和二氧化硅杂质,现欲制取纯净的氧化铝,某同学设计如下的实验方案,请回答下列问题:
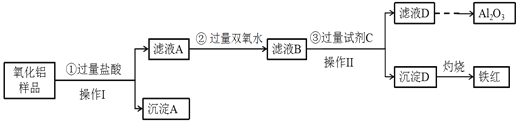
①操作I的名称是_________,该操作用到的玻璃棒的作用 ___________________ 。
②沉淀A的成分是__________(填化学式);验证滤液A中存在Fe3+的具体操作和现象为: _______________________________________________________________。
③用离子方程式说明步骤②中双氧水的作用:
______________________________________________________________。
④滤液D焰色反应呈黄色,试剂C是 ______________(填化学式);
步骤③中铝元素转化的离子方程式 : ___________________________________________ 。
【答案】 Fe3+ +3H2O ==== Fe(OH)3(胶体)+3H+ a c d Cu+2FeCl3=2FeCl2+CuCl2 过滤 引流,防止液体飞溅 SiO2 取少量滤液A于试管中,滴几滴KSCN溶液,如果溶液变红色,说明溶液中有Fe3+ H2O2 + 2Fe2+ +2H+ = 2Fe3+ + 2H2O NaOH Al3+ + 4OH-==AlO2-+2 H2O
【解析】(1)将FeCl3溶液滴入沸水中并煮沸一段时间,Fe3+水解生成氢氧化铁胶体,该反应的离子方程式为Fe3++3H2O=Fe(OH)3(胶体)+3H+;氢氧化铁胶体具有丁达尔效应、电泳、聚沉等性质,将液体加热蒸干、灼烧后,可得Fe2O3固体,加入硝酸银电解质后胶体发生聚沉现象,答案选acd;(2)氯化铁与铜反应的化学方程式为Cu+2FeCl3=2FeCl2+CuCl2。(3)氧化铝样品中含有氧化铁、氧化亚铁和二氧化硅,加入过量盐酸,氧化铝、氧化亚铁、氧化铁溶解生成氯化铝、氯化铁、氯化亚铁溶液,过滤得到沉淀A为二氧化硅,滤液A为氯化铁、氯化亚铁和氯化铝溶液,加入过量过氧化氢溶液氧化亚铁离子为铁离子,得到滤液B,加入过量试剂C为强碱溶液生成氢氧化铁沉淀和偏铝酸盐溶液,过滤得到沉淀D为Fe(OH)3,滤液D为含偏铝酸盐,通入过量二氧化碳气体反应生成氢氧化铝沉淀和碳酸氢盐,过滤得到氢氧化铝沉淀,加热分解生成氧化铝,沉淀D灼烧得到铁红氧化铁。
①操作I是分离固体和溶液,操作的名称是过滤,该操作用到的玻璃棒的作用是引流、防止液体飞溅。②沉淀A的成分是SiO2,验证滤液A中存在Fe3+的具体操作和现象为取少量滤液A于试管中,滴几滴KSCN溶液,如果溶液变红色,说明溶液中有Fe3+;③双氧水与亚铁离子反应的方程式为H2O2+2Fe2++2H+=2Fe3++2H2O。④滤液D焰色反应呈黄色,试剂C是NaOH溶液,步骤③中铝元素转化的离子方程式为Al3++4OH-=AlO2-+2H2O。

 智能训练练测考系列答案
智能训练练测考系列答案【题目】请回答下列问题.
(1)水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度. 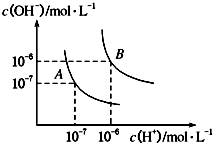
①100℃时1molL﹣1的NaOH溶液中,由水电离出的c(H+)=molL﹣1 , KW(25℃)KW(100℃)(填“>”、“<”或“=”).
②25℃时,向水的电离平衡体系中加入少量NH4Cl固体,对水的电离平衡的影响是(填“促进”、“抑制”或“不影响”).
(2)电离平衡常数是衡量弱电解质电离程度强弱的量.已知如表数据.
化学式 | 电离平衡常数(25℃) |
HCN | K=4.9×10﹣10 |
CH3COOH | K=1.8×10﹣5 |
H2CO3 | K1=4.3×10﹣7、K2=5.6×10﹣11 |
①25℃时,有等浓度的a.NaCN溶液 b.CH3COONa 溶液 c.Na2CO3溶液,三种溶液的pH由大到小的顺序为;(填序号)
②25℃时,等浓度的CH3COOH溶液和NaOH溶液等体积混合,则c(Na+)c(CH3COO﹣)(填“>”、“<”或“=”).
【题目】下列实验操作能达到实验目的的是
选项 | 实验操作 | 实验目的 |
A | 向盛有2mL0.1mo/LAgNO3溶液的试管中滴加一定量0.1mo/LNaCl溶液,再向其中滴加一定量0.1mol/LKI溶液 | 证明相同温度下的溶度积常数Ksp(AgCl)>Ksp(AgI) |
B | 取两支试管,分别加入4mL0.01mol/LKMnO4酸性溶液,然后向一支试管中加入0.1mol/LH2C2O4液2mL,向另一支试管中加入0.1mol/L H2C2O4液4mL,记录褪色时间 | 证明草酸浓度越大,反应速率越大 |
C | 向盛有1mL浓硫酸的试管中加入5mL0.01mol/LK2Cr2O7溶液 | 证明增大生成物的浓度,使平衡Cr2O72-(橙色)+H2O |
D | 向混有BaCO3沉淀的NaOH溶液中满入已知浓度的盐酸(用酚酞作指示剂) | 滴定其中的NaOH含量 |
A. A B. B C. C D. D