题目内容
(5分)德国和美国科学家首次制造出了由20个碳原子组成的空心笼状分子C20,该笼状结构是由许多正五边形构成的(如图所示)。请回答:
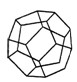
C20分子中共有 个正五边形,共有 条棱边。
C20晶体属于 (填晶体类型)。

C20分子中共有 个正五边形,共有 条棱边。
C20晶体属于 (填晶体类型)。
12;30;分子晶体
略

练习册系列答案
 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案
相关题目
题目内容


 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案