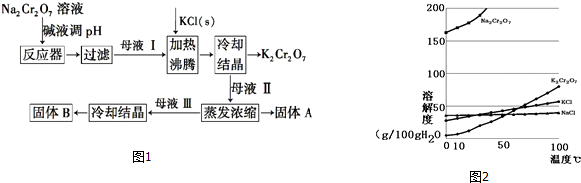
题目内容
18.某化学兴趣小组为探究铜与浓硫酸的反应,用如图所示装置进行有关实验.甲同学取ag铜片和12mL 18mol•L-1浓硫酸放入圆底烧瓶中加热,直到反应完毕,最后发现烧瓶中还有一定量的H2SO4和Cu剩余.
(1)Cu与浓硫酸反应的化学方程式是Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O+SO2↑.装置E中试管D内盛有品红溶液,当C中气体集满后,D中有可能观察到的现象是品红溶液褪色
为避免实验装置D有可能造成的环境污染,可用浸有NaOH溶液的棉花团塞在试管口,其反应原理是SO2+2OH-=SO32-+H2O(用离子方程式表示).
(2)装置B的作用是贮存多余的气体,B中应放置的液体是D(填序号).
a.饱和Na2SO3溶液 b.酸性KMnO4溶液 c.浓溴水d.饱和NaHSO3溶液
当D处有明显现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中现象是液体被压入长颈漏斗.
(3)反应完毕后,烧瓶中还有一定量的余酸,却不能使Cu完全溶解的原因是浓度减小,变为稀硫酸后,不能继续和铜发生反应;使用足量的下列药品不能用来证明反应结束后的烧瓶中的确有余酸的是b(填序号).
a.铁粉 b.BaCl2溶液 c.CuO d.Na2CO3溶液
实验中某学生向A中反应后溶液中通入一种常见气体单质,使铜片全部溶解且仅生成硫酸铜溶液,该反应的化学方程式是2Cu+O2+2H2SO4═2CuSO4+2H2O.
分析 (1)根据铜是金属,具有还原性,浓硫酸具有强氧化性,加热反应生成硫酸铜、二氧化硫和水;当C中气体集满,D中逸出二氧化硫,遇到品红试液会变红色;二氧化硫能够与氢氧化钠溶液反应,可以用浸有NaOH溶液的棉团塞在试管口吸收二氧化硫;
(2)B中液体不与二氧化硫反应,也不溶解二氧化硫,关闭旋塞K,移去酒精灯,但由于余热的作用,生成气体导致装置B中压强增大液体被压入长颈漏斗,据此进行分析;
(3)浓硫酸和铜发生反应随浓度减小,变为稀硫酸后,不能继续和铜发生反应,证明硫酸剩余,需要证明反应后的溶液中存在大量氢离子;
稀硫酸和铜不发生反应,通入氧气后能够反应生成硫酸铜,据此写出反应的化学方程式.
解答 解:(1)铜跟浓硫酸反应,铜具有还原性,浓硫酸具有强氧化性,反应必须加热才能发生,书写化学方程式时注意“浓”字,反应的化学方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O+SO2↑;装置E中试管D内盛品红溶液,当C中气体集满,D中有二氧化硫,二氧化硫能和有色物质品红溶液生成无色物质;二氧化硫有毒,不能直接排放,氢氧化钠溶液能够与二氧化硫反应,可用浸有NaOH溶液的棉团塞在试管口吸收二氧化硫,反应的离子方程式为:SO2+2OH-=SO32-+H2O,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O+SO2↑;品红溶液褪色,SO2+2OH-=SO32-+H2O;
(2)装置B的作用是贮存多余的气体,所以B中应放置的液体不能与二氧化硫反应,也不能溶解二氧化硫,而A.饱和Na2SO3溶液、B.酸性KMnO4溶液、C.浓溴水都能够与二氧化硫反应,只有D.饱和NaHSO3溶液符合要求,生成气体导致装置B中压强增大液体被压入长颈漏斗,
故答案为:D,液体被压入长颈漏斗;
(3)直到反应完毕,最后发现烧瓶中还有一定量的H2SO4和Cu剩余,原因是浓硫酸和铜发生反应随浓度减小,变为稀硫酸后,不能继续和铜发生反应,证明反应后有硫酸剩余,需要证明反应后的溶液中存在大量氢离子,根据金属活动顺序表可知铁能和氢离子反应,稀硫酸与BaC12溶液反应生成硫酸钡,但是不能证明是否含有氢离子;与Na2CO3溶液反应生成二氧化碳,证明溶液中含有氢离子,氧化铜能溶于酸,故选b,实验中甲学生向A中反应后溶液中通入一种常见气体单质,使铜片全部溶解且仅生成硫酸铜溶液,该气体单质具有强氧化性,又是常见的,可以为氧气;铜和氧气、稀硫酸发生氧化还原反应,得到硫酸铜和水,反应的化学方程式为:2Cu+O2+2H2SO4═2CuSO4+2H2O,
故答案为:b;2Cu+O2+2H2SO4═2CuSO4+2H2O.
点评 本题考查了浓硫酸的性质,题目难度中等,试题涉及铜与浓硫酸的反应原理、二氧化硫的性质及检验方法、化学方程式的书写等知识,注意掌握浓硫酸具有的性质,明确化学实验基本操作方法.

 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案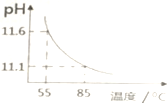
| A. | c(H+)增大,c(OH-)减小 | B. | $\frac{c(C{{O}_{3}}^{2-})}{c(HC{{O}_{3}}^{-})}$比值不断增大 | ||
| C. | c(CO32-)+c(HCO3-)+c(H2CO3)=0.10 | D. | c(OH-)-c(HCO3-)-c(H2CO3)=10-11.1 |
①分子数相等
②原子数相等
③质量相等
④摩尔质量相等.
| A. | ①④ | B. | ③④ | C. | ②③ | D. | ①② |

| A. | 溶液中HCO3-的数目 | B. | 溶液的pH | ||
| C. | CO32- 水解的平衡常数 | D. | 溶液中的c(CO32-) |
 某同学做“证明鸡蛋壳的主要成分是碳酸盐”的实验时,设计了如图所示的方案.经检验装置气密性合格并加入试剂.下列说法中不正确的是( )
某同学做“证明鸡蛋壳的主要成分是碳酸盐”的实验时,设计了如图所示的方案.经检验装置气密性合格并加入试剂.下列说法中不正确的是( )| A. | Ⅰ中发生的现象为鸡蛋壳逐渐溶解,产生大量气泡 | |
| B. | Ⅱ中的澄清石灰水变浑浊 | |
| C. | Ⅲ中紫色石蕊试液变红 | |
| D. | 鸡蛋壳发生了分解反应 |
已知:2CH3CHO+O2$→_{△}^{催化剂}$2CH3COOH
(1)写出A的电子式
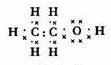 .
.(2)反应Ⅱ的化学方程式是2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.
(3)D为高分子化合物,可以用来制造多种包装材料,其结构简式是
 .
.(4)E是有香味的物质,在实验室用图2装置制取.
①反应IV的化学方程式是CH3COOH+HOCH2CH3
 CH3COOCH2CH3+H2O,该反应类型为酯化反应或取代反应.
CH3COOCH2CH3+H2O,该反应类型为酯化反应或取代反应.②该装置图中有一个明显的错误是导气管的出口伸入到饱和碳酸钠溶液液面以下.
(5)为了证明浓硫酸在反应IV中起到了催化剂和吸水剂的作用,某同学利用上图改进后装置进行了以下4个实验.实验开始先用酒精灯微热3min,再加热使之微微沸腾3min.实验结束后充分振荡小试管乙再测有机层的厚度,实验记录如下:
| 实验编号 | 试管甲中试剂 | 试管乙中 试剂 | 有机层的 厚度/cm |
| A | 2mL乙醇、1mL乙酸、 1mL18mol•L-1 浓硫酸 | 饱和Na2CO3 溶液 | 3.0 |
| B | 2mL乙醇、1mL乙酸 | 0.1 | |
| C | 2mL乙醇、1mL乙酸、 3mL 2mol•L-1 H2SO4 | 0.6 | |
| D | 2mL乙醇、1mL乙酸、盐酸 | 0.6 |
②分析实验AC(填实验编号)的数据,可以推测出浓H2SO4的吸水性提高了乙酸乙酯的产率.

| A. | 氨水的主要成分是NH3•H2O | |
| B. | 氨水可使酚酞指示剂变红 | |
| C. | 氨水中含三种分子和两种离子 | |
| D. | 氨水中溶质的质量分数越大,溶液密度越小 |
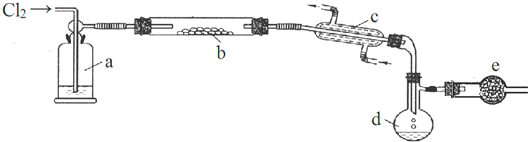
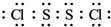 ;
;