题目内容
3.用pH传感器测得0.10mol•L-1Na2CO3溶液从55℃升高至85℃的pH如图所示.在55℃升高至85℃升温过程中,下列说法正确的是( )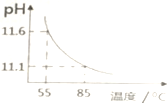
| A. | c(H+)增大,c(OH-)减小 | B. | $\frac{c(C{{O}_{3}}^{2-})}{c(HC{{O}_{3}}^{-})}$比值不断增大 | ||
| C. | c(CO32-)+c(HCO3-)+c(H2CO3)=0.10 | D. | c(OH-)-c(HCO3-)-c(H2CO3)=10-11.1 |
分析 A.升高温度后,碳酸钠的水解程度增大,溶液则溶液中氢氧根离子浓度增大;根据图象可知,温度升高后溶液pH减小,则溶液中氢离子浓度增大;
B.碳酸钠的水解为吸热反应,升高温度后碳酸根离子的水解程度增大,则溶液中碳酸根离子浓度减小,碳酸氢根离子浓度增大;
C.根据碳酸钠溶液中的物料守恒判断;
D.根据碳酸钠溶液中的质子守恒判断.
解答 解:A.结合图象可知,在55℃升高至85℃后,溶液的pH减小,则溶液中c(H+)增大;温度升高后碳酸钠的电离程度增大,则溶液中c(OH-)增大,故A错误;
B.升高温度后碳酸钠的水解程度增大,则溶液中碳酸根离子浓度减小、碳酸氢根离子浓度增大,该比值会减小,故B错误;
C.根据物料守恒可得:c(CO32-)+c(HCO3-)+c(H2CO3)=0.10mol/L,故C正确;
D.根据质子守恒可得:c(OH-)-c(HCO3-)-2c(H2CO3)=c(H+)=10-11.1mol/L,故D错误;
故选C.
点评 本题考查了离子浓度大小比较,题目难度中等,明确盐的水解原理及其影响为解答关键,注意掌握电荷守恒、物料守恒及质子守恒在判断离子浓度大小中的应用方法,A为易错点,需要明确温度对水的电离、盐的水解的影响.

练习册系列答案
相关题目
13.下列说法不正确的是( )
| A. | 在稀硫酸中加入铜粉,铜粉不溶解,再加入Cu(NO3)2固体,铜粉仍不溶解 | |
| B. | 某气体能使湿润的红色石蕊试纸变蓝,该气体的水溶液一定显碱性 | |
| C. | 浓硝酸与木炭反应的离子方程式:C+4H++4NO3-=CO2↑+4NO2↑+2H2O | |
| D. | HNO3→NO→NO2,以上各步变化均能通过一步实现 |
11.下列说法不正确的是( )
| A. | 葡萄糖、氨基酸在一定条件下都能发生酯化反应 | |
| B. |  的分子式为C17H26O3 的分子式为C17H26O3 | |
| C. | 等质量的甲醛与乳酸[CH3CH(OH)COOH]完全燃烧时消耗氧气的量相等 | |
| D. | 结构片段为 的高聚物,是其单体通过缩聚反应生成的 的高聚物,是其单体通过缩聚反应生成的 |
18.水的作用与反应Br2+SO2+2H2O═H2SO4+2HBr不相同的是( )
| A. | 2Na2O2+2H2O═4NaOH+O2↑ | B. | 4Fe(OH)2+O2+2H2O═4Fe(OH)3 | ||
| C. | Cl2+H2O═HCl+HClO | D. | 2Al+2NaOH+2H2O═2NaAlO2+3H2↑ |
8.下列说法不正确的是( )
| A. | Na2CO3溶液中c(Na+)与c(CO32-)之比大于2:1 | |
| B. | 蒸发氯化铝溶液要不断通入氯化氢气体方可得到氯化铝晶体 | |
| C. | 1 L 0.3 mol/L醋酸溶液中H+个数与3 L 0.1 mol/L醋酸溶液中H+个数之比为1:1 | |
| D. | 浓度相同的下列溶液中,按pH由小到大的顺序排列的是CH3COONa、NaHCO3、Na2CO3 |
15.下列关于蛋白质的说法中,错误的是( )
| A. | 蛋白质是人体必需的生命物质 | |
| B. | 酶也是一种蛋白质 | |
| C. | 蛋白质是一种小分子化合物 | |
| D. | 蛋白质的相对分子质量通常很大,有的甚至达到几万或几百万 |
