题目内容
【题目】用菱锰矿(主要含MnCO3、FeCO3、Al2O3、SiO2)制备MnSO4·H2O的工艺流程如下:
Ⅰ.向菱锰矿中加入过量稀H2SO4,过滤;
Ⅱ.向滤液中加入过量MnO2,过滤;
Ⅲ.调节滤液pH=a,过滤;
Ⅳ.浓缩、结晶、分离、干燥得到产品;
Ⅴ.检验产品纯度。
(1)步骤Ⅰ中,滤渣的主要成分是 。
(2)将MnO2氧化Fe2+的离子方程式补充完整:
![]() MnO2 +
MnO2 +![]() Fe2++
Fe2++![]() =
=![]() Mn2+ +
Mn2+ + ![]() Fe3+ +
Fe3+ +![]()
(3)与选用Cl2作为氧化剂相比,MnO2的优势主要在于:原料来源广、成本低、可避免环境污染、 。
(4)已知:生成氢氧化物沉淀的pH
Al(OH)3 | Fe(OH)2 | Fe(OH)3 | Mn(OH)2 | |
开始沉淀时 | 3.4 | 6.3 | 1.5 | 7.6 |
完全沉淀时 | 4.7 | 8.3 | 2.8 | 10.2 |
注:金属离子的起始浓度为0.1mol/L
步骤Ⅲ中a的取值范围是 。
(5)步骤Ⅴ,通过测定产品中锰元素的质量分数来判断产品纯度。
已知一定条件下,MnO4-与Mn2+反应生成MnO2 。取x g产品配成溶液,用0.1mol/L KMnO4溶液滴定,消耗KMnO4溶液y mL,产品中锰元素的质量分数为 。
【答案】(1)SiO2
(2)1 2 4H+ 1 2 2H2O
(3)不会引入Cl-,使制得的MnSO4H2O产品更纯净
(4)4.7≤a<7.6
(5)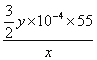
【解析】
试题分析: 菱锰矿(主要含MnCO3、FeCO3、Al2O3、SiO2),加入过量稀H2SO4,生成硫酸锰、硫酸亚铁、硫酸铝溶液,二氧化硅不溶解,;向滤液中加入过量MnO2,将亚铁离子氧化为铁离子,本身被还原为二价锰离子,调节滤液pH,使三价铁离子和铝离子沉淀,过滤除去氢氧化铁和氢氧化铝固体,对硫酸锰溶液进行浓缩、冷切结晶、过滤、洗涤干燥得到产品。(1)菱锰矿(主要含MnCO3、FeCO3、Al2O3、SiO2),加入过量稀H2SO4,生成硫酸锰、硫酸亚铁、硫酸铝溶液,二氧化硅不溶解,滤渣的主要成分是二氧化硅,故答案为:二氧化硅;(2)锰元素化合价由+4价降低到+2价,铁元素由+2价升高到+3价,根据化合价升降守恒、电荷守恒、原子守恒,配平反应为MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O,故答案为:MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;(3)选用Cl2作为氧化剂会最后的溶液中引入氯离子,使制得的产品不纯,而MnO2不会引入Cl-,使制得的MnSO4H2O产品更纯净,故答案为:不会引入Cl-,使制得的MnSO4H2O产品更纯净;(4)调节滤液pH,使三价铁离子和铝离子沉淀,根据表格可知二价锰离子开始沉淀的pH=7.6,铝离子开始沉淀的pH=4.7,故4.7≤a<7.6,故答案为:4.7≤a<7.6;(5)设含有硫酸锰的物质的量为z,根据方程式
3Mn2++2MnO4-+2H2O=5MnO2+4H+
3mol 2mol
z 0.1y×10-3mol
z=0.15y×10-3mol,
锰元素的质量分数=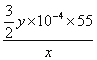

 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案