题目内容
A、B、C、D、E、F为前四周期元素且原子序数依次增大,其中A含有3个能级,且每个能级所含的电子数相同;C的最外层有6个运动状态不同的电子;D是短周期元素中电负性最小的元素;E的最高价氧化物的水化物酸性最强;F除最外层原子轨道处于半充满状态,其余能层均充满电子。G元素与D元素同主族,且相差3个周期。
(1)元素A、B、C的第一电离能由小到大的是_______用元素符号表示)。
(2)E的最高价含氧酸中E的杂化方式为_______。
(3)F原子的外围电子排布式为________________________________________,F的晶体中原子的堆积方式是下图中的_______(填写“甲”、“乙”或“丙”)。

(4)DE,GE两种晶体,都属于离子晶体,但配位数不同,其原因是______________________。
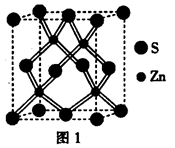
(5)已知DE晶体的晶胞如下图所示:若将DE晶胞中的所有E离子去掉,并将D离子全部换为A原子,再在其中的4个“小立方体”中心各放置一个A原子,且这4个“小立方体”相邻。位于“小立方体”中的A原子与最近的4个A原子以单键相连,由此表示A的一种晶体的晶胞(已知A — A键的键长acm, NA表示阿伏加德罗常数),则该晶胞中含有个 A原子,该晶体的密度是_____g/cm3。
(1)元素A、B、C的第一电离能由小到大的是_______用元素符号表示)。
(2)E的最高价含氧酸中E的杂化方式为_______。
(3)F原子的外围电子排布式为________________________________________,F的晶体中原子的堆积方式是下图中的_______(填写“甲”、“乙”或“丙”)。

(4)DE,GE两种晶体,都属于离子晶体,但配位数不同,其原因是______________________。
(5)已知DE晶体的晶胞如下图所示:若将DE晶胞中的所有E离子去掉,并将D离子全部换为A原子,再在其中的4个“小立方体”中心各放置一个A原子,且这4个“小立方体”相邻。位于“小立方体”中的A原子与最近的4个A原子以单键相连,由此表示A的一种晶体的晶胞(已知A — A键的键长acm, NA表示阿伏加德罗常数),则该晶胞中含有个 A原子,该晶体的密度是_____g/cm3。

(1)C<O<N(2分) (2)sp3杂化(2分) (3)3d104s1(2分);丙(2分)
(4)正负离子的半径比不同(2分)
(5)8(2分);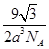 或
或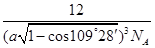 或
或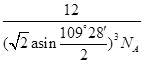 (3分)
(3分)
(4)正负离子的半径比不同(2分)
(5)8(2分);
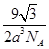 或
或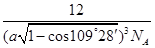 或
或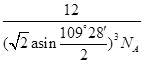 (3分)
(3分)试题分析:A、B、C、D、E、F为前四周期元素且原子序数依次增大,其中A含有3个能级,且每个能级所含的电子数相同,因此A的原子序数是6,即A是碳元素;C的最外层有6个运动状态不同的电子,则C是第ⅥA族元素;D是短周期元素中电负性最小的元素,说明D的金属性最强,短周期中金属性最强的是钠,则D是钠;C的原子序数小于钠的,所以C是氧元素;B的原子序数介于A和C之间,则B是氮元素;E的最高价氧化物的水化物酸性最强,因此E是氯元素;F除最外层原子轨道处于半充满状态,其余能层均充满电子,则F的原子序数是2+8+18+1=29,所以F是铜;G元素与D元素同主族,且相差3个周期,所以G是第六周期的Cs元素。
(1)非金属性越强第一电离能越大,但由于氮元素的2p轨道电子处于半充满状态,稳定性强,因此氮元素的第一电离能大于氧元素的第一电离能,即元素A、B、C的第一电离能由小到大的是C<O<N。
(2)E的最高价含氧酸是高氯酸,化学式为HClO4。根据价层电子对互斥理论可知。氯元素含有的孤对电子对数=
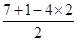 =0,所以氯元素的杂化方式为sp3杂化。
=0,所以氯元素的杂化方式为sp3杂化。(3)根据核外电子的排布规律可知,铜原子的外围电子排布式为3d104s1。铜形成的晶体是面心立方最密堆积,甲是六方最密堆积,乙是体心立方堆积,丙是面心立方最密堆积,因此答案选丙。
(4)NaCl、CsCl的阴阳离子的个数之比都是1:1,都属于AB型离子晶体,但由于晶体中正负离子的半径比不同,因此二者的配位数不同,前者是6,后者是8。
(5)若将氯化钠晶胞中的所有氯离子去掉,并将吗离子全部换为碳原子,再在其中的4个“小立方体”中心各放置一个A原子,且这4个“小立方体”相邻,则根据均摊法可知该晶胞中含有的碳原子个数=12×
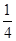 +1+4=8个;“小立方体”中心放置一个A原子,则以该碳原子为中心与小立方体的4个碳原子构成正四面体,因此根据余弦定理可知小立方体面心半径=
+1+4=8个;“小立方体”中心放置一个A原子,则以该碳原子为中心与小立方体的4个碳原子构成正四面体,因此根据余弦定理可知小立方体面心半径=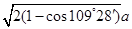 ,则小立方体的边长=
,则小立方体的边长=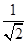 ×
×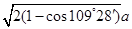 =
=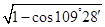 a,则该晶胞的边长=2a
a,则该晶胞的边长=2a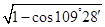 ,所以该晶胞的体积=(2a
,所以该晶胞的体积=(2a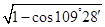 )3。该晶胞中含有8个碳原子,则晶胞的密度=
)3。该晶胞中含有8个碳原子,则晶胞的密度=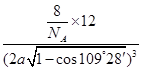 =
=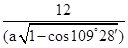 。
。
练习册系列答案
相关题目

 ),下列说法正确的是________(填序号)。
),下列说法正确的是________(填序号)。

 实现储氢和输氢。下列说法正确的是 ;
实现储氢和输氢。下列说法正确的是 ;
 、
、 两种可能,经证实
两种可能,经证实 不溶于
不溶于 等非极性溶剂。”据此可确定
等非极性溶剂。”据此可确定 中化学键类型为________。
中化学键类型为________。 采用“…ABCABC…”型堆积方式,抽出一个晶胞,其正确的是________,
采用“…ABCABC…”型堆积方式,抽出一个晶胞,其正确的是________,
 则Pt原子的半径为_________pm(Pt的相对原子质量195.1)
则Pt原子的半径为_________pm(Pt的相对原子质量195.1) 和
和 ,它们都有很强的氧化性,
,它们都有很强的氧化性,


 ,平面结构)属于________(填“极性”或“非极性”)分子。
,平面结构)属于________(填“极性”或“非极性”)分子。