题目内容
同一周期(短周期)各元素形成单质的沸点变化如下图所示(按原子序数连续递增顺序排列)。该周期部分元素氟化物的熔点见下表。

(1)A原子核外共有________种不同运动状态的电子、_______种不同能级的电子;
(2)元素C的原子核外电子排布式______________________;
(3)解释上表中氟化物熔点差异的原因:__________________________;
(4)在E、G、H三种元素形成的氢化物中,热稳定性最大的是________(填化学式)。A、B、C三种原子形成的简单离子的半径由大到小的顺序为___________(填离子符号)。

(1)A原子核外共有________种不同运动状态的电子、_______种不同能级的电子;
(2)元素C的原子核外电子排布式______________________;
(3)解释上表中氟化物熔点差异的原因:__________________________;
(4)在E、G、H三种元素形成的氢化物中,热稳定性最大的是________(填化学式)。A、B、C三种原子形成的简单离子的半径由大到小的顺序为___________(填离子符号)。
(1)11; 4 (各1分,共2分)
(2)1s22s22p63s23p1(2分)
(3)NaF与MgF2为离子晶体,SiF4为分子晶体,故SiF4的熔点低;(1分)Mg2+的半径比Na+的半径小,且所带电荷多,故所带电荷多,故MgF2的熔点比NaF高。(1分)
(4)HCl;Na+ > Mg2+ > Al3+ (各1分,共2分)
(2)1s22s22p63s23p1(2分)
(3)NaF与MgF2为离子晶体,SiF4为分子晶体,故SiF4的熔点低;(1分)Mg2+的半径比Na+的半径小,且所带电荷多,故所带电荷多,故MgF2的熔点比NaF高。(1分)
(4)HCl;Na+ > Mg2+ > Al3+ (各1分,共2分)
试题分析:图中曲线表示8种元素的原子序数(按递增顺序连续排列)和单质沸点的关系,H、I的沸点低于0℃,根据气体的沸点都低于0℃,可推断H、I为气体,含两种气体单质的周期为第三周期,则A为Na,B为Mg,C为Al,D为Si,E为P、G为S,H为Cl,I为Ar。
(1)A为Na元素,原子核外电子数为11,故共有11种同运动状态的电子,原子核外电子排布式为1s22s22p63s1,有4种不同能级的电子。
(2)C为Al元素,原子核外电子数为13,原子核外电子排布式为:1s22s22p63s23p1
(3)首先判断各物质的晶体类型,相同类型的晶体再比较微粒间作用力的强弱,NaF与 MgF2为离子晶体,SiF4为分子晶体,故SiF4的熔点低;Mg2+的半径比Na+的半径小,故MgF2的熔点比NaF高。
(4)同周期自左而右非金属性增强,非金属性Cl>S>P,非金属性越强氢化物越稳定,故HCl最稳定性;Na+、Mg2+、Al3+电子层结构相同,电子层结构相同核电荷数越大离子半径越小,故离子半径Na+>Mg2+>Al3+。

练习册系列答案
相关题目


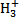 、—CH3(甲基)、C
、—CH3(甲基)、C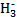 都是重要的有机反应中间体,有关它们的说法中正确的是( )
都是重要的有机反应中间体,有关它们的说法中正确的是( )