题目内容
2012年12月,我国成功实现歼—15飞机在“辽宁号”航母上的起降实验,建造航母平台和舰载飞机离不开如钛、物质A等材料。请回答下列问题:
(1)写出钛基态原子的核外电子排布式:___________________________。
(2)已知元素A处于第3周期,其原子的第一至第四电离能数据如表所示:
①A的元素符号为________。
②与元素A同周期的电负性最大的元素为________(填元素符号),该元素能与同周期的另一种非金属元素形成5原子分子,该分子的中心原子采用的杂化方式是________,该分子的空间构型为________。
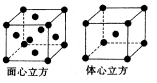
(3)钛镁合金是制造高性能飞机的重要材料。已知钛、镁金属均采用六方最密堆积( ),下列说法正确的是________(填序号)。
),下列说法正确的是________(填序号)。
A.用钛镁合金来制造高性能飞机,主要由于其价格昂贵,制造出的飞机能卖个好价钱
B.在高温下切割金属钛不会产生任何安全事故
C.钛、镁金属晶体中,其配位数均为12
D.金属钛的熔点很高(1 668 ℃),与金属键关系不大
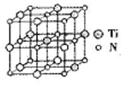
(4)钙钛型复合氧化物(如图所示)可用于制造航空母舰中的热敏传感器,该晶体以A原子为晶胞的顶点,A可以是Ca、Sr、Ba或Pb,当B是V、Cr、Mn或Fe时,这种化合物具有很好的电化学性能。用A、B、O表示钙钛型复合氧化物晶体的化学式为________。

(1)写出钛基态原子的核外电子排布式:___________________________。
(2)已知元素A处于第3周期,其原子的第一至第四电离能数据如表所示:
| 电离能(kJ/mol) | I1 | I2 | I3 | I4 |
| A | 738 | 1 451 | 7 733 | 10 540 |
①A的元素符号为________。
②与元素A同周期的电负性最大的元素为________(填元素符号),该元素能与同周期的另一种非金属元素形成5原子分子,该分子的中心原子采用的杂化方式是________,该分子的空间构型为________。
(3)钛镁合金是制造高性能飞机的重要材料。已知钛、镁金属均采用六方最密堆积(
 ),下列说法正确的是________(填序号)。
),下列说法正确的是________(填序号)。A.用钛镁合金来制造高性能飞机,主要由于其价格昂贵,制造出的飞机能卖个好价钱
B.在高温下切割金属钛不会产生任何安全事故
C.钛、镁金属晶体中,其配位数均为12
D.金属钛的熔点很高(1 668 ℃),与金属键关系不大
(4)钙钛型复合氧化物(如图所示)可用于制造航空母舰中的热敏传感器,该晶体以A原子为晶胞的顶点,A可以是Ca、Sr、Ba或Pb,当B是V、Cr、Mn或Fe时,这种化合物具有很好的电化学性能。用A、B、O表示钙钛型复合氧化物晶体的化学式为________。

(1)1s22s22p63s23p63d24s2(或[Ar]3d24s2)
(2)①Mg ②Cl sp3杂化 正四面体
(3)C (4)ABO3
(2)①Mg ②Cl sp3杂化 正四面体
(3)C (4)ABO3
(1)钛的原子序数为22,其基态原子的核外电子排布式为1s22s22p63s23p63d24s2。(2)①由元素A的电离能数据可知,第一和第二电离能相对较小,第三和第四电离能相对较大,故元素A应为第3周期ⅡA族的Mg。②与Mg同周期的电负性最大的元素为Cl,与Cl同周期的非金属元素还有Si、P、S,但能与Cl形成5原子分子的元素为Si,SiCl4中Si原子采用sp3杂化,该分子的空间构型为正四面体。(3)选项A,用钛镁合金来制造高性能飞机与材料的结构和性质有关,并不在于其价格昂贵。选项B,由金属钛在元素周期表中的位置可知,钛是一种较活泼的金属,高温下能与空气中的O2等反应,从而出现严重的安全事故。选项C,钛、镁金属晶体中,原子周围最近且等距离的钛、镁原子数均为12,所以其配位数均为12。选项D,金属的熔点高低是由金属键的强弱决定的。(4)根据“均摊法”,一个晶胞中含有A原子的数目为8×1/8=1,含有B原子的数目为1,含有O原子的数目为6×1/2=3,故该晶体的化学式为ABO3。

练习册系列答案
相关题目
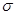 键与
键与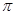 个数的比值为___________________。
个数的比值为___________________。


 、—CH3(甲基)、C
、—CH3(甲基)、C 都是重要的有机反应中间体,有关它们的说法中正确的是( )
都是重要的有机反应中间体,有关它们的说法中正确的是( )