题目内容
【题目】二氧化氯(ClO2)具有强氧化性,在工业上常用作水处理剂、漂白剂。ClO2是一种易溶于水的黄绿色气体,其体积分数超过10%时易引起爆炸。某研究小组欲用以下三种方案制备ClO2,回答下列问题:
(1)以黄铁矿(FeS2)、氯酸钠和硫酸溶液混合反应制备ClO2,黄铁矿中的硫元素在酸性条件下被ClO3-氧化成SO42-,写出制备ClO2的离子方程式__。
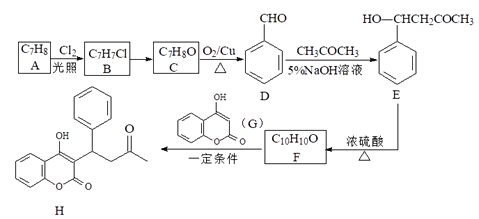
(2)用过氧化氢作还原剂,在硫酸介质中还原NaClO3制备ClO2,并将制得的ClO2用于处理含CN-废水。实验室模拟该过程的实验装置(夹持装置略)如图所示。

①装置A的名称是__,装置C的作用是__。
②反应容器B应置于30℃左右的水浴中,目的是__。
③通入氮气的主要作用有3个,一是可以起到搅拌作用,二是有利于将ClO2排出,三是__。
④ClO2处理含CN-废水的离子方程式为__,装置E的作用是__。
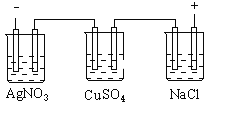
(3)氯化钠电解法是一种可靠的工业生产ClO2的方法。
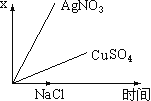
①用于电解的食盐水需先除去其中的Ca2+、Mg2+、SO42-等杂质。某次除杂操作时,往粗盐水中先加入过量的__(填化学式),至沉淀不再产生后,再加入过量的Na2CO3和NaOH,充分反应后将沉淀一并滤去。
②用石墨做电极,在一定条件下电解饱和食盐水制取ClO2,工作原理如图所示,写出阳极产生ClO2的电极反应式__。

【答案】FeS2+15ClO3-+14H+=15ClO2+Fe3++2SO42-+7H2O 恒压漏斗 安全瓶 提高化学反应速率,同时防止过氧化氢受热分解 稀释ClO2,防止其爆炸 2CN-+2ClO2=2CO2+N2+2Cl- 吸收ClO2等气体,防止污染大气 BaCl2 Cl--5e-+2H2O=ClO2↑+4H+
【解析】
二氧化氯(ClO2)具有强氧化性,在工业上常用作水处理剂、漂白剂。分别利用无机反应和电解原理制备二氧化氯,三种方法均利用了氧化还原反应。
(1)以黄铁矿(FeS2)、氯酸钠和硫酸溶液混合反应制备ClO2,黄铁矿中的硫元素在酸性条件下被ClO3-氧化成SO42-,根据氧化还原反应中电子守恒和元素守恒,可以写出制备ClO2的离子方程式为FeS2+15ClO3-+14H+=15ClO2+Fe3++2SO42-+7H2O。
(2)①装置A的名称为恒压漏洞,装置C为安全瓶,起到防止液体倒吸的作用。
②升高温度可以提高化学反应速率,但是原料中含有过氧化氢,过氧化氢在过高的温度下可以发生分解反应,因此反应容器B应置于30℃左右的水浴中。
③根据题文可知,ClO2是一种易溶于水的黄绿色气体,其体积分数超过10%时易引起爆炸,故通入氮气的主要作用有3个,一是可以起到搅拌作用,二是有利于将ClO2排出,三是稀释ClO2,防止其爆炸。
④ClO2处理含CN-废水发生氧化还原反应,将CN-转化为无污染的CO2和N2,故离子方程式为2CN-+2ClO2=2CO2+N2+2Cl-;装置E在整套装置之后,起到吸收尾气,防止环境污染的作用。
(3)①用于电解的食盐水需先除去其中的Ca2+、Mg2+、SO42-等杂质,需要过量的碳酸根离子、氢氧根离子和钡离子,过量的钡离子可以用碳酸根离子除去,因此在加入Na2CO3之前应先加入过量BaCl2。
②用石墨做电极,电解池的阳极发生氧化反应,元素化合价升高,因此氯离子在阳极失电子和水反应得到ClO2,电极反应式为Cl--5e-+2H2O=ClO2↑+4H+。

【题目】 H2O2是一种绿色试剂,在化学工业中用于生产过氧乙酸、亚氯酸钠等的原料,医药工业用作杀菌剂、消毒剂.某化学小组欲探究双氧水的性质做了如下实验:
(1)下表是该小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据:用![]() 制取
制取![]() 所需的时间
所需的时间![]() 秒
秒![]()
浓度 时间 反应条件 |
|
|
|
|
无催化剂、不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
无催化剂、加热 | 360 | 480 | 540 | 720 |
| 10 | 25 | 60 | 120 |
①研究小组在设计方案时,考虑了浓度、 ______ 、 ______ 因素对过氧化氢分解速率的影响。(2)另一研究小组拟在同浓度Fe3+的催化下,探究H2O2浓度对H2O2分解反应速率的影响,限选试剂与仪器![]() 、
、![]() 、蒸馏水、锥形瓶、双孔塞、水槽、胶管、玻璃导管、量筒、秒表、恒温水浴槽、注射器。设计实验装置,完成图1方框内的装置示意图
、蒸馏水、锥形瓶、双孔塞、水槽、胶管、玻璃导管、量筒、秒表、恒温水浴槽、注射器。设计实验装置,完成图1方框内的装置示意图![]() 要求所测得的数据能直接体现反应速率大小_________
要求所测得的数据能直接体现反应速率大小_________
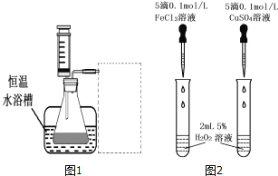
(3)对于H2O2分解反应,![]() 也有一定的催化作用。为比较Fe3+和
也有一定的催化作用。为比较Fe3+和![]() 对H2O2分解的催化效果,研究小组的同学设计了如图2所示的实验。请回答相关问题:
对H2O2分解的催化效果,研究小组的同学设计了如图2所示的实验。请回答相关问题:
①可通过观察 ____________ ,比较得出结论。
②有同学提出将![]() 的
的![]() 溶液改为
溶液改为![]() 更为合理,其理由是 _________ 。
更为合理,其理由是 _________ 。
(4)已知![]() 溶液中主要含有H2O、Fe3+和Cl-三种微粒,甲同学又做了两种猜想:
溶液中主要含有H2O、Fe3+和Cl-三种微粒,甲同学又做了两种猜想:
猜想1:真正催化分解H2O2的是![]() 溶液中的Fe3+
溶液中的Fe3+
猜想2:真正催化分解H2O2的是 __________________
完成表格,验证猜想:
所需试剂 | 操作及现象 | 结论 |
_________ | __________ | Cl-对H2O2分解无催化作用 |