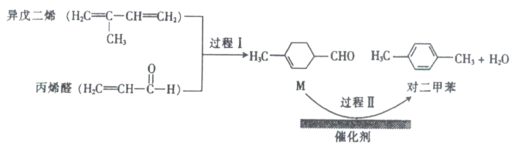
题目内容
【题目】某药物H的一种合成路线如下:

回答下列问题:
(1)C的名称是______________。
(2)F→H的反应类型为______________。B→C的试剂和条件是_____________。
(3)H有多种同分异构体,在下列哪种仪器中可以显示物质中化学键和官能团类型______(填字母)。
A.质谱仪 B.元素分析仪 C.红外光谱仪 D.核磁共振氢谱仪
(4)写出D→E的化学方程式___________。
(5)在E的同分异构体中,同时满足下列条件的结构有____种;其中核磁共振氢谱有六组峰,且峰面积之比为3:3:2:2:1:1的是______。
①既能发生银镜反应,又能发生水解反应;②属于芳香族化合物;③苯环上只有2个取代基。
(6)参照上述流程,以D和乙醛为原料合成![]() (其他无机试剂自选),设计合成路线:____________。
(其他无机试剂自选),设计合成路线:____________。
【答案】苯甲醇 加成反应 氢氧化钠水溶液,加热 C  15
15 ![]()
![]()
【解析】
由D逆推,D为苯甲醛,则A中也有苯环,1个侧链。A的分子式C7H8,A为甲苯。A在光照条件下,和氯气反应,侧链上的H原子被Cl原子取代,B为![]() 。B在NaOH水溶液中、加热发生水解,C为苯甲醇,D为苯甲醛。E的分子式为C10H12O2,E反应生成的F分子式为C10H10O,为消去反应,结合条件为醇羟基在浓硫酸的作用下发生消去反应。F为
。B在NaOH水溶液中、加热发生水解,C为苯甲醇,D为苯甲醛。E的分子式为C10H12O2,E反应生成的F分子式为C10H10O,为消去反应,结合条件为醇羟基在浓硫酸的作用下发生消去反应。F为![]() 。G与F的碳碳双键发生加成反应生成H。
。G与F的碳碳双键发生加成反应生成H。
(1) 根据上述分析,C为苯甲醇;
(2) 可以推出F的结构简式为![]() ,从G和H的结构来看,G与F的碳碳双键发生加成反应生成H,F→H的反应类型为加成反应。B为
,从G和H的结构来看,G与F的碳碳双键发生加成反应生成H,F→H的反应类型为加成反应。B为![]() ,在NaOH水溶液中、加热水解生成C为苯甲醇,答案为加成反应; 氢氧化钠水溶液,加热;
,在NaOH水溶液中、加热水解生成C为苯甲醇,答案为加成反应; 氢氧化钠水溶液,加热;
(3)
A.质谱中质荷比最大的数据为相对分子质量,不能显示物质中的官能团和化学键类型;
B.元素分析仪确定物质中含有的元素,不能显示物质中的官能团和化学键类型;
C.红外光谱仪能显示物质中的官能团和化学键类型;
D.核磁共振氢谱能测定物质中氢原子的种类和个数,不能显示物质中的官能团和化学键类型。
答案选C。
(4) D为苯甲醛,丙酮中甲基上氢原子与醛基发生加成反应。答案为 ;
;
(5)依题意,①既能发生银镜反应,又能发生水解反应;但是E中只有2个O原子,因此同分异构体为甲酸酯。E除去苯环上的6个碳原子,还有4个碳原子,有两个取代基,其中有一端必须为甲酸酯,苯环上两个取代基的组成方式有5种:
①HCOOCH2CH2—、—CH3;②HCOOCH(CH3)—、—CH3;③HCOOCH2—、—CH2CH3;④HCOO—、—CH2CH2CH3 ;⑤HCOO—、—CH(CH3)2,两个取代基均存在邻、间、对三种结构,共15种同分异构体;其中核磁共振氢谱有六组峰,且峰面积之比为3:3:2:2:1:1的是![]() ;
;
(6)模仿D→E→F的转化原理,苯甲醛与乙醛发生加成反应,再脱水,最后加成生成目标产物。答案为:![]() 。
。

 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案【题目】将H2S转化为可再利用的资源是能源研究领域的重要课题。
(1)H2S的转化
Ⅰ | 克劳斯法 |
|
Ⅱ | 铁盐氧化法 |
|
Ⅲ | 光分解法 |
|
① 反应Ⅰ的化学方程式是________。
② 反应Ⅱ:____+ 1 H2S ==____Fe2+ + ____S↓ + ____(将反应补充完整)。
③ 反应Ⅲ体现了H2S的稳定性弱于H2O。结合原子结构解释二者稳定性差异的原因:_______。
(2)反应Ⅲ硫的产率低,反应Ⅱ的原子利用率低。我国科研人员设想将两个反应耦合,实现由H2S高效产生S和H2,电子转移过程如图。
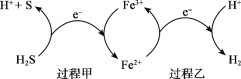
过程甲、乙中,氧化剂分别是______。
(3)按照设计,科研人员研究如下。
① 首先研究过程乙是否可行,装置如图。经检验,n极区产生了Fe3+,p极产生了H2。n极区产生Fe3+的可能原因:

ⅰ.Fe2+ - e- = Fe3+
ⅱ.2H2O -4e-=O2 +4H+,_______(写离子方程式)。经确认,ⅰ是产生Fe3+的原因。过程乙可行。
② 光照产生Fe3+后,向n极区注入H2S溶液,有S生成,持续产生电流,p极产生H2。研究S产生的原因,设计如下实验方案:______。 经确认,S是由Fe3+氧化H2S所得,H2S不能直接放电。过程甲可行。
(4)综上,反应Ⅱ、Ⅲ能耦合,同时能高效产生H2和S,其工作原理如图。

进一步研究发现,除了Fe3+/Fe2+ 外,I3-/I- 也能实现如图所示循环过程。结合化学用语,说明I3-/I- 能够使S源源不断产生的原因:________。