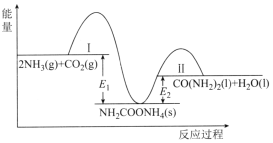
题目内容
【题目】已知:A可作为水果催熟剂,D是一种合成高分子材料,G是一种有果香味的物质。现以C4H10为原料合成D、G的路线设计如下:

请回答下列问题:
(1)D的名称为___。反应②的反应类型是___。
(2)写出反应⑥的化学方程式:___。为加快⑥的反应速率,采取的措施有___。
(3)比C4H10多1个碳的同系物存在多种同分异构体,写出它们的结构简式:___。
【答案】聚氯乙烯 消去反应 CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O 加浓硫酸、加热 CH3CH2CH2CH2CH3、CH3CH2CH(CH3)2、CH3C(CH3)3
CH3COOCH2CH3+H2O 加浓硫酸、加热 CH3CH2CH2CH2CH3、CH3CH2CH(CH3)2、CH3C(CH3)3
【解析】
A可作为水果催熟剂,A为CH2=CH2,由转化关系可知E为CH3CH2OH,F为CH3COOH,G为CH3COOCH2CH3,B为CH2ClCH2Cl,C为CH2=CHCl,D为![]() ,据此解答该题。
,据此解答该题。
A可作为水果催熟剂,A为CH2=CH2,由转化关系可知E为CH3CH2OH,F为CH3COOH,G为CH3COOCH2CH3,B为CH2ClCH2Cl,C为CH2=CHCl,D为![]() ,
,
(1)D为 ![]() ,名称为聚氯乙烯;反应②为CH2ClCH2Cl在加热的条件下转化为CH2=CHCl,该反应从CH2ClCH2Cl分子内脱去一小分子的HCl,形成碳碳双键,属于消去反应;
,名称为聚氯乙烯;反应②为CH2ClCH2Cl在加热的条件下转化为CH2=CHCl,该反应从CH2ClCH2Cl分子内脱去一小分子的HCl,形成碳碳双键,属于消去反应;
故答案为:聚氯乙烯;消去反应;
(2)反应⑥为乙酸和乙醇在浓硫酸加热的条件下发生酯化反应生成乙酸乙酯和水,反应的化学方程式为:CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O;为加快该反应速率,采取的措施有加浓硫酸、加热;
CH3COOCH2CH3+H2O;为加快该反应速率,采取的措施有加浓硫酸、加热;
故答案为:CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O;加浓硫酸、加热;
CH3COOCH2CH3+H2O;加浓硫酸、加热;
(3)比C4H10多1个碳的同系物存在多种同分异构体,为戊烷的同分异构体,有正戊烷、异戊烷、新戊烷,它们的结构简式为:CH3CH2CH2CH2CH3、CH3CH2CH(CH3)2、CH3C(CH3)3;
故答案为:CH3CH2CH2CH2CH3、CH3CH2CH(CH3)2、CH3C(CH3)3。

 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案【题目】下列实验操作、现象及所得出的结论或解释均正确的是( )
选项 | 实验操作 | 现象 | 结论或解释 |
A | 向次氯酸钙溶液中通入二氧化硫 | 产生白色沉淀 | 酸性:H2SO3>HClO |
B | 向废FeCl3蚀刻液X中加入少量的铁粉,振荡 | 未出现红色固体 | X中一定不含Cu2+ |
C | 向饱和硅酸钠溶液中加入浓盐酸 | 产生白色沉淀 | 制取硅酸胶体 |
D | 铬酸钠溶液中加入浓硫酸 | 溶液由黄色变为橙色 | 氢离子浓度对该反应的化学平衡有影响 |
A.AB.BC.CD.D
【题目】氧化铍(BeO)常温下为不溶于水、易溶于强酸和强碱的固体,除用作耐火材料外,还可以用于制霓虹灯和铍合金。工业上以硅铍石(主要含有BeO、SiO2、MgO,还含有少量Al2O3和Fe2O3)制备高纯度BeO的流程如图所示:

已知:①BeO为离子化合物,熔点为2350℃,BeC12和NaC1等比例混合的固体混合物在350℃即可熔化;
②不同金属阳离子在D2EHPA中的溶解性如下表所示:
Be2+ | Mg2+ | Fe3+ | Al3+ | |
D2EHPA中的溶解性 | 易溶 | 难溶 | 微溶 | 微溶 |
请回答下列问题:
(1)“滤渣1”的主要成分为__(填化学式)。“残液”中含量最多的金属元素为__(填名称)。
(2)“萃取”后铍元素以Be(HX2)2的形式存在于有机相中,“反萃取”后以(NH4)2Be(CO3)2的形式存在于水相中,则“反萃取”时含铍微粒发生反应的化学方程式为___。
(3)“净化”时需将反萃取液加热到70℃,加热到70℃的目的为__。
(4)由2BeCO3·Be(OH)2制备高纯BeO的方法是__。
(5)BeO的电子式为__。工业上常采用电解熔融BeC12与NaC1等比例混合物的方法制备金属Be,不采用电解熔融BeO制备的主要原因为___。
【题目】铍铜是广泛应用于制造高级弹性元件的良好合金。某科研小组从某废旧铍铜元件(含25%BeO、71%CuS、少量FeS和SiO2)中回收铍和铜两种金属的工艺流程如下:

已知:I、铍、铝元素化学性质相似;BeCl2熔融时能微弱电离;
Ⅱ、常温下部分难溶物的溶度积常数如下表:
难溶物 | Cu(OH)2 | Fe(OH)3 | Mn(OH)2 |
溶度积常数(Ksp) | 2.2×10—20 | 4.0×10—38 | 2.1×10—13 |
(1)滤液A的主要成分除NaOH外,还有___________(填化学式),写出反应I中含铍化合物与过量盐酸反应的离子方程式:__________。
(2)①滤液C中含NaCl、BeCl2和少量HCl,为提纯BeCl2,最合理的实验步骤顺序为_______(填字母)
a.加入过量的氨水 b.通入过量的CO2 c.加入过量的NaOH d.加入适量的HCl e.洗涤 f.过滤
②从BeCl2溶液中获得BeCl2的晶体易带结晶水,但是将BeCl2晶体与SOCl2(易水解,产物之一能使品红褪色)混合可得无水BeCl2,请从平衡移动角度解释原因:__________。
(3)MnO2能将金属硫化物中的硫元素氧化为硫单质,写出反应Ⅱ中CuS发生反应的化学方程式:______。
(4)滤液D中c(Cu2+)=2.2mol·L-1、c(Fe3+)=0.0080mol·L-1、c(Mn2+)=0.010mol·L-1,缓慢通氨气调节pH可将其依次分离(体积变化忽略不计)。当Cu2+恰好完全沉淀(c(Cu2+)=1.0×10-5 mol·L-1)时,溶液中c(Cu2+)/ c(Fe3+)约为______。(![]() ≈4.7,保留两位有效数字)
≈4.7,保留两位有效数字)
(5)电解NaCl-BeCl2混合熔盐可制备金属铍。
①电解过程中,加入氯化钠的目的是________。
②电解得到的Be蒸气中约含1%的Na蒸气除去Be中少量Na的方法为________。已知部分物质的熔沸点如下表:
物质 | 熔点(K) | 沸点(K) |
Be | 1551 | 3243 |
Na | 370 | 1156 |