题目内容
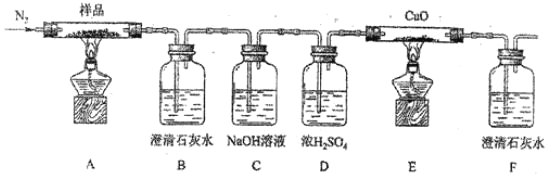
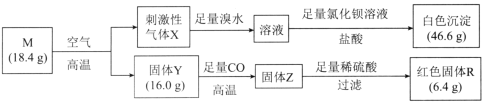
【题目】化合物M由两种位于第四周期的过渡金属元素和一种位于第三周期的非金属元素组成,一定条件下M存在如图所示转化。已知:固体Y中两种金属元素的化合价分别为+2、+3。下列有关推断错误的是( )
A.气体X能使品红溶液、酸性高锰酸钾溶液、含酚酞的碳酸钠溶液褪色
B.溴水吸收气体X的离子方程式为Br2+2H2O+SO22HBr+2H++SO![]()
C.根据上述数据推知,M的化学式为CuFeS2
D.向KNO3和稀盐酸的混合溶液中加入少量固体Z,固体Z全部溶解
【答案】B
【解析】
M在空气中灼烧,产生刺激性气味的气体X,气体X和溴水反应后的溶液与氯化钡反应生成的沉淀是硫酸钡,硫酸钡的物质的量是![]() ,所以M中含有S元素,且物质的量是0.2mol,气体X是二氧化硫;固体Y是金属氧化物,被CO还原为金属Z,红色固体R难溶于硫酸,所以R是Cu,铜的质量是6.4g,固体Y中两种金属元素的化合价分别为+2、+3,则另一种金属为+3价,设另一种金属为T ,氧化物的化学式是
,所以M中含有S元素,且物质的量是0.2mol,气体X是二氧化硫;固体Y是金属氧化物,被CO还原为金属Z,红色固体R难溶于硫酸,所以R是Cu,铜的质量是6.4g,固体Y中两种金属元素的化合价分别为+2、+3,则另一种金属为+3价,设另一种金属为T ,氧化物的化学式是![]() 根据元素守恒,T元素的质量是
根据元素守恒,T元素的质量是![]() ;
;![]() 的质量是
的质量是![]() ,设T元素的相对分子质量是a,则
,设T元素的相对分子质量是a,则![]() ,a=56g/mol,所以T是铁元素。
,a=56g/mol,所以T是铁元素。
A.气体X是二氧化硫,二氧化硫能使品红溶液、酸性高锰酸钾溶液、含酚酞的碳酸钠溶液褪色,故A正确;
B.溴水和二氧化硫反应生成硫酸和氢溴酸,反应的离子方程式为Br2+2H2O+SO2=2Br-+4H++SO![]() ,故B错误;
,故B错误;
C.根据上述数据推知,18.4g M含有Fe元素的物质的量是![]() 、Cu元素的物质的量是
、Cu元素的物质的量是![]() 、S元素的物质的量是0.2mol,M的化学式为CuFeS2,故C正确;
、S元素的物质的量是0.2mol,M的化学式为CuFeS2,故C正确;
D.固体Z是铁、铜的混合物,铁、铜都能溶液稀硝酸,向KNO3和稀盐酸的混合溶液中加入少量固体Z,固体Z全部溶解,故D正确;
选B。

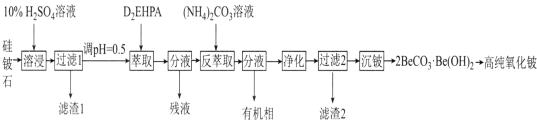
【题目】氧化铍(BeO)常温下为不溶于水、易溶于强酸和强碱的固体,除用作耐火材料外,还可以用于制霓虹灯和铍合金。工业上以硅铍石(主要含有BeO、SiO2、MgO,还含有少量Al2O3和Fe2O3)制备高纯度BeO的流程如图所示:
已知:①BeO为离子化合物,熔点为2350℃,BeC12和NaC1等比例混合的固体混合物在350℃即可熔化;
②不同金属阳离子在D2EHPA中的溶解性如下表所示:
Be2+ | Mg2+ | Fe3+ | Al3+ | |
D2EHPA中的溶解性 | 易溶 | 难溶 | 微溶 | 微溶 |
请回答下列问题:
(1)“滤渣1”的主要成分为__(填化学式)。“残液”中含量最多的金属元素为__(填名称)。
(2)“萃取”后铍元素以Be(HX2)2的形式存在于有机相中,“反萃取”后以(NH4)2Be(CO3)2的形式存在于水相中,则“反萃取”时含铍微粒发生反应的化学方程式为___。
(3)“净化”时需将反萃取液加热到70℃,加热到70℃的目的为__。
(4)由2BeCO3·Be(OH)2制备高纯BeO的方法是__。
(5)BeO的电子式为__。工业上常采用电解熔融BeC12与NaC1等比例混合物的方法制备金属Be,不采用电解熔融BeO制备的主要原因为___。
【题目】铍铜是广泛应用于制造高级弹性元件的良好合金。某科研小组从某废旧铍铜元件(含25%BeO、71%CuS、少量FeS和SiO2)中回收铍和铜两种金属的工艺流程如下:
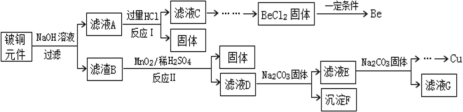
已知:I、铍、铝元素化学性质相似;BeCl2熔融时能微弱电离;
Ⅱ、常温下部分难溶物的溶度积常数如下表:
难溶物 | Cu(OH)2 | Fe(OH)3 | Mn(OH)2 |
溶度积常数(Ksp) | 2.2×10—20 | 4.0×10—38 | 2.1×10—13 |
(1)滤液A的主要成分除NaOH外,还有___________(填化学式),写出反应I中含铍化合物与过量盐酸反应的离子方程式:__________。
(2)①滤液C中含NaCl、BeCl2和少量HCl,为提纯BeCl2,最合理的实验步骤顺序为_______(填字母)
a.加入过量的氨水 b.通入过量的CO2 c.加入过量的NaOH d.加入适量的HCl e.洗涤 f.过滤
②从BeCl2溶液中获得BeCl2的晶体易带结晶水,但是将BeCl2晶体与SOCl2(易水解,产物之一能使品红褪色)混合可得无水BeCl2,请从平衡移动角度解释原因:__________。
(3)MnO2能将金属硫化物中的硫元素氧化为硫单质,写出反应Ⅱ中CuS发生反应的化学方程式:______。
(4)滤液D中c(Cu2+)=2.2mol·L-1、c(Fe3+)=0.0080mol·L-1、c(Mn2+)=0.010mol·L-1,缓慢通氨气调节pH可将其依次分离(体积变化忽略不计)。当Cu2+恰好完全沉淀(c(Cu2+)=1.0×10-5 mol·L-1)时,溶液中c(Cu2+)/ c(Fe3+)约为______。(![]() ≈4.7,保留两位有效数字)
≈4.7,保留两位有效数字)
(5)电解NaCl-BeCl2混合熔盐可制备金属铍。
①电解过程中,加入氯化钠的目的是________。
②电解得到的Be蒸气中约含1%的Na蒸气除去Be中少量Na的方法为________。已知部分物质的熔沸点如下表:
物质 | 熔点(K) | 沸点(K) |
Be | 1551 | 3243 |
Na | 370 | 1156 |