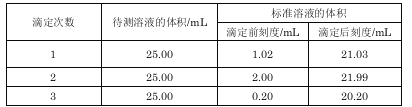
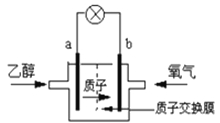
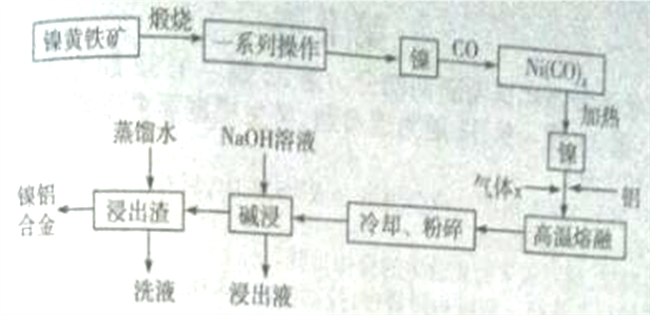
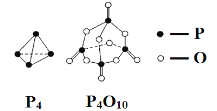
题目内容
【题目】草酸钴是制作氧化钴和金属钴的原料。一种利用含钴废料(主要成分Co2O3),含少量Fe2O3、MnO2、Al2O3、CaO、MgO、碳及有机物等)制取草酸钴(CoC2O3)的工艺流程如下:

已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等。
②部分阳离子一氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
完全沉淀时的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
③Kap(MgF2)=7.35×10-11,Kap(CaF2)=1.05×10-10
回答下列问题:
(1)焙烧的目的是_________;浸钴过程中Co3+转化为Co2+,反应的离子方程式为_____________。
(2)加入H2O2的目的是__________,加入Na2CO3溶液,调pH至5.2,滤渣Ⅰ主要成分为__________。
(3)加入过量NaF溶液,可将Ca2+、Mg2+除去,若所得滤液中c(Ca2+)=1.0×10-5mol·L-1,则滤液中c(Mg2+)为_______________。
(4)萃取剂对金属离子的萃取率与pH的关系如下图所示。滤液Ⅱ中加入萃取剂的作用是_________;萃取时,溶液的pH需要控制在一定范围内才比较适宜,其pH范围约为__________。

(5)已知含钴废料中含Co2O3质量分数为a%,若取mg该含钴废料按照上述流程,理论上最多能制得CoC2O4的质量为__________g(列出计算式即可)。
【答案】 除去碳和有机物 2Co3++SO32-+ H2O= 2Co2++SO42-+2H+ 将 Fe2+氧化为 Fe3+ Al(OH)3、Fe(OH)3 7.0×10-6 mol ·L-1 除去Mn2+ 3.0~3.5 147ma%/83 或 1.77×10-2ma
【解析】本题考查化学工艺流程,从化学反应原理入手,(1)根据含有物质,焙烧的目的是除去C和有机物;根据浸钴步骤,得出反应是Co3++SO32-→Co2++SO42-,根据化合价的升降进行配平,得出2Co3++SO32-→2Co2++SO42-,利用原子守恒和电荷守恒,离子反应方程式为:2Co3++SO32-+ H2O= 2Co2++SO42-+2H+;(3)过氧化氢具有氧化性,以及浸出液中所含离子,因此过氧化氢的目的是将Fe2+氧化成Fe3+;加入Na2CO3调节pH到5.2,根据完全沉淀时溶液的pH,推出滤渣1成分是Fe(OH)3和Al(OH)3;(3)溶液中有F-,因此有c(Ca2+)/c(Mg2+)=c(Ca2+)×c2(F-)/[c2(F-)×c(Mg2+)]=Ksp(CaF2)/Ksp(MgF2),解得c(Mg2+)=7×10-6mol·L-1;(4)根据流程图,加入萃取剂的目的是除去Mn2+;应选择浸取率最高的,因此因此pH的范围是3.0~3.5;(5)根据钴元素守恒,因此m(CoC2O4)=ma%×2×147/162g。

 备战中考寒假系列答案
备战中考寒假系列答案【题目】下表是元素周期表的一部分,请回答有关问题:
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
二 | ① | ② | ||||||
三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
四 | ⑨ | ⑩ |
(1)表中化学性质最不活泼的元素是______。(用元素符号表示)
(2)②③④三种元素的原子半径从大到小的顺序是______(用元素符号表示)
(3)用电子式表示③与⑦形成化合物的过程_______________________。
(4)在①~⑧元素中,元素的最高价氧化物对应的水化物中碱性最强的___。(填化学式)
(5)在⑦与⑩的单质中,化学性质较活泼的是_____。(填化学式)