题目内容
【题目】CH4-CO2催化重整时发生反应:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g),不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。回答下列问题:
2CO(g)+2H2(g),不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。回答下列问题:
(1)某温度下,向1L的密闭容器中充入0.2molCH4与0.1molCO2,发生CH4-CO2催化重整反应,10min时达到平衡,测得平衡混合物中CO(g)的体积分数为20%,则用CH4表示的反应速率为______,CO2的平衡转化率为______。
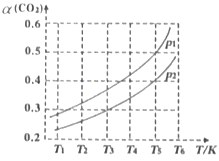
(2)若CO2的平衡转化率(a)与温度(T)、压强(p)的关系如图所示。由图可知:压强p1______p2(选填“>“、“<“或“=”),理由是______。
(3)在一定温度下,向固定容积为2L的密闭容器中充入0.1moCH4与0.1mo1CO2发生CH4-CO2催化重整反应,达平衡时CO2的平衡转化率为50%,则此条件下该反应的平衡常数为K=______;平衡后保持温度不变,若再充入0.15molCH4、0.15molCO2、0.1molCO、0.1molH2,则此时v正______(选填“>”、“<”或“=”)v逆。
(4)已知:C(s)+2H2(g)=CH4(g)△H1=-75 kJmol-1
C(s)+O2(g)=CO2(g)△H2=-394 kJmol-1
C(s)+![]() O2(g)=CO(g)△H3=-111 kJmol-1
O2(g)=CO(g)△H3=-111 kJmol-1
①催化重整反应CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)的△H=______kJmol-1。
2CO(g)+2H2(g)的△H=______kJmol-1。
②反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。相关数据如下表:
积碳反应CH4(g)=C(s)+2H2(g) | 消碳反应CO2(g)+C(s)=CO(g) | ||
△H/(kJmol-1) | 75 | 172 | |
活化能/(kJmol-1) | 催化剂X | 33 | 91 |
催化剂Y | 43 | 72 | |
由上表判断,催化剂X______Y(填“优于”或“劣于”),理由是______。
【答案】![]() 37.5% < 当温度一定时,压强越大,平衡向逆反应方向移动,CO2的平衡转化率越小,图中压强p1对应的转化率大于p2,则压强p1<p2 6.25×10-4 < +247 劣于 相对于催化剂X,催化剂Y积碳反应的活化能大,积碳反应的速率小,而消碳反应活化能相对小,消碳反应速率大
37.5% < 当温度一定时,压强越大,平衡向逆反应方向移动,CO2的平衡转化率越小,图中压强p1对应的转化率大于p2,则压强p1<p2 6.25×10-4 < +247 劣于 相对于催化剂X,催化剂Y积碳反应的活化能大,积碳反应的速率小,而消碳反应活化能相对小,消碳反应速率大
【解析】
(1)发生的反应为:
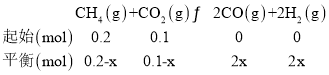
平衡化合物中CO的体积分数为20%,所以![]() ,解得
,解得![]() ,所以用CH4表示的反应速率为
,所以用CH4表示的反应速率为![]() ,CO2的平衡转化率;
,CO2的平衡转化率;
(2)随着反应进行,气体分子数增多,体系压强增大,减压有利于反应正向进行,说明较低的压强对应较高的平衡转化率,所以p1<p2;
(3)发生的反应为:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g),平衡时CO2的平衡转化率为50%,
2CO(g)+2H2(g),平衡时CO2的平衡转化率为50%,
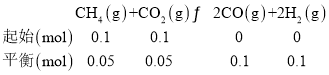
 ,平衡后保持温度不变,若再充入0.15molCH4、0.15molCO2、0.1molCO、0.1molH2,则
,平衡后保持温度不变,若再充入0.15molCH4、0.15molCO2、0.1molCO、0.1molH2,则 ,所以反应逆向进行,v正<v逆;
,所以反应逆向进行,v正<v逆;
(4)①CH4-CO2催化重整反应的化学方程式为CH4(g)+CO2(g)![]() 2CO(g)+2H2(g),
2CO(g)+2H2(g),
①C(s)+2H2(g)=CH4(g)△H1=-75 kJmol-1
②C(s)+O2(g)=CO2(g)△H2=-394 kJmol-1
③C(s)+![]() O2(g)=CO(g)△H3=-111 kJmol-1
O2(g)=CO(g)△H3=-111 kJmol-1
根据盖斯定律③×2-①-②计算CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)的焓变△H=(-111 kJmol-1)×2-(-75 kJmol-1)-(-394 kJmol-1)=+247kJ/mol;
2CO(g)+2H2(g)的焓变△H=(-111 kJmol-1)×2-(-75 kJmol-1)-(-394 kJmol-1)=+247kJ/mol;
②消碳反应所需活化能越低,消碳反应越容易进行,催化剂活性越好,根据表中数据知,催化剂X较催化剂Y,积碳反应时,活化能低,反应速率快,消碳反应时,活化能高,反应速率慢,综合考虑,催化剂X较催化剂Y更利于积碳反应,不利于消碳反应,会降低催化剂活性。

【题目】将等物质的量的X、Y气体充入某密闭容器中,在一定条件下,发生如下反应并达到平衡:
X(g)+ 3Y(g) ![]() 2Z(g) △H<0 当改变某个条件并维持新条件直至新的平衡时,下表中关于新平衡与原平衡的比较正确的是
2Z(g) △H<0 当改变某个条件并维持新条件直至新的平衡时,下表中关于新平衡与原平衡的比较正确的是
选项 | 改变条件 | 新平衡与原平衡比较 |
A | 升高温度 | X的转化率变小 |
B | 增大压强 | X的浓度变小 |
C | 充入一定量Y | Y的转化率增大 |
D | 使用适当催化剂 | X的体积分数变小 |
A. A B. B C. C D. D
【题目】炼锌烟尘(主要成份为ZnO,含少量CuO和FeO)为原料,可以制取氯化锌和金属锌。制取氯化锌主要工艺如下:
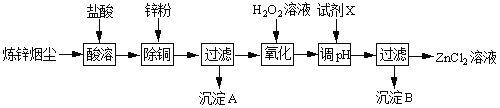
下表列出相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0molL1计算)。
金属离子 | Fe3+ | Zn2+ | Fe2+ |
开始沉淀的pH | 1.1 | 5.2 | 5.8 |
沉淀完全的pH | 3.2 | 6.4 | 8.8 |
(1)加入H2O2溶液的作用是___。
(2)流程图中,调节pH时,加入的试剂X可以是______(填序号),pH应调整到___。
A.ZnO B.NaOH C.Zn2(OH)2CO3 D.ZnSO4
【题目】(1)下表是几种常见弱酸的电离平衡常数(25℃)
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
①根据分析表格中数据可知,H2CO3、CH3COOH、HClO三种酸的酸性从强到弱依次是___;下列反应不能发生的是___(填字母)。
a.CO32-+2CH3COOH=2CH3COO-+CO2↑+H2O
b.CO32-+2HClO=CO2↑+H2O+2ClO-
c.ClO-+CH3COOH=CH3COO-+HClO
d.2ClO-+CO2+H2O=CO32-+2HClO
②碳酸钠溶液中各离子浓度从大到小的顺序依次为:___。
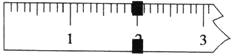
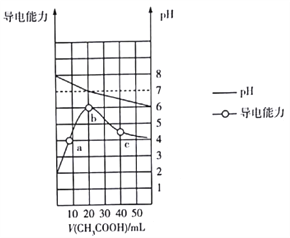
(2)体积均为10 mL、pH均为2的醋酸溶液与HX溶液分别加水稀释至1000 mL,稀释过程中pH变化如图所示。稀释后,HX溶液中水电离出来的c(H+)__(填“>”、“=”或“<”)醋酸溶液中水电离出来的c(H+);

(3)25℃时,向50mL0.018mol·L-1的AgNO3溶液中加入50mL0.020mol·L-1的盐酸生成沉淀。已知该温度下AgCl的Ksp=1.0×10-10,忽略溶液混合后体积的变化,请计算:
①完全沉淀后,溶液中c(Ag+)=__mol·L-1。
②完全沉淀后,溶液的pH=__。