题目内容
【题目】K3[Fe(C2O4)3]·3H2O〔三草酸合铁(Ⅲ)酸钾晶体〕是制备负载型活性铁催化剂的主要原料,也是一些有机反应很好的催化剂。下图是在实验室制备K3[Fe(C2O4)3]·3H2O的流程:

回答下列问题:
(1)步骤I中加入稀硫酸的目的是_______________。
步骤II中发生的主要化学反应为一可逆过程,其离子方程式为_______________。
常温下,该反应的平衡常数K=_______________[已知常温下:Ka1(H2C2O4)=5.6×10-2、Ka2(H2C2O4)=5.4×10-5、Ksp(FeC2O4)=2.1×10-7]
(2)下列试剂均可将FeC2O4氧化为K3[Fe(C2O4)3],最适宜作为“试剂a”的是_______________(填序号)
a.氯水b.酸性KMnO4溶液c.H2O2溶液d.稀硝酸
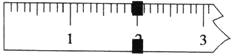
(3)使用托盘天平称量制得的K3[Fe(C2O4)3]·3H2O的质量。天平平衡时,右盘内砝码的总质量为20 g.游码示数如图所示,则制得晶体的质量为___________g,该实验中K3[Fe(C2O4)3]·3H2O的产率为_______________。(已知: K3[Fe(C2O4)3]·3H2O的相对分子质量为491,FeSO4·7H2O的相对分子质量为278)
(4)某研究小组将K3[Fe(C2O4)3〕在一定条件下加热分解后,利用下图所示装置(可重复使用)确认所得含碳元素的气体产物为CO和CO2。

按气流从左到右的方向,装置的连接顺序为_______________(填装置序号) ;确认气体产物中含CO的现象为_______________。
【答案】抑制Fe2+水解 Fe2++ H2C2O4![]() FeC2O4↓+2H+ 14.4 c 21.9 44.6% DCDBAD A中黑色粉末变为红色,其后的D中澄清石灰水变浑浊
FeC2O4↓+2H+ 14.4 c 21.9 44.6% DCDBAD A中黑色粉末变为红色,其后的D中澄清石灰水变浑浊
【解析】
(1) 步骤Ⅰ中:亚铁离子在水溶液中水解:Fe2++2H2O![]() Fe(OH)2+2H+,溶解的过程中要加入几滴稀硫酸,目的是抑制Fe2+水解;
Fe(OH)2+2H+,溶解的过程中要加入几滴稀硫酸,目的是抑制Fe2+水解;
在步骤I制备的溶液中加入25mL饱和H2C2O4溶液,搅拌并加热煮沸,晶体颗粒长大形成黄色FeC2O42H2O沉淀,离子方程式为Fe2++ H2C2O4![]() FeC2O4↓+2H+;
FeC2O4↓+2H+;
Fe2++ H2C2O4![]() FeC2O4↓+2H+的平衡常数K=
FeC2O4↓+2H+的平衡常数K=![]() ,
,
根据H2C2O4![]() H++ HC2O4-,HC2O4-
H++ HC2O4-,HC2O4-![]() H++ C2O42-,
H++ C2O42-,
K1=![]() ,K2=
,K2=![]()
根据的溶解平衡方程式:FeC2O4![]() Fe2++ C2O42-,Ksp(FeC2O4)=c(Fe2+)c (C2O42-),
Fe2++ C2O42-,Ksp(FeC2O4)=c(Fe2+)c (C2O42-),
可知,K=![]() =
=![]() =14.4,
=14.4,
故答案为:抑制Fe2+水解;Fe2++ H2C2O4![]() FeC2O4↓+2H+;14.4;
FeC2O4↓+2H+;14.4;
(2)为了不引入杂质,将FeC2O4氧化为K3[Fe(C2O4)3],最好需要双氧水,
故选选c;
(3)根据题意和图示,制得晶体的质量为21.9g;27.8gFeSO4·7H2O的物质的量为![]() =0.1mol,根据铁元素守恒,理论上可以生成0.1molK3[Fe(C2O4)3]·3H2O,质量为49.1g,K3[Fe(C2O4)3]·3H2O的产率为
=0.1mol,根据铁元素守恒,理论上可以生成0.1molK3[Fe(C2O4)3]·3H2O,质量为49.1g,K3[Fe(C2O4)3]·3H2O的产率为![]() ×100%=44.6%,
×100%=44.6%,
故答案为:21.9;44.6%;
(4)二氧化碳能够是澄清石灰水变浑浊,一氧化碳具有还原性,被氧化生成二氧化碳,因此首先检验二氧化碳,除净二氧化碳后再检验一氧化碳,从左到右,装置的连接顺序为DCDBAD,当看到第一个澄清石灰水变浑浊,证明有二氧化碳,当看到A中黑色粉末变为红色,其后的D中澄清石灰水变浑浊,证明有一氧化碳,
故答案为:DCDBAD;A中黑色粉末变为红色,其后的D中澄清石灰水变浑浊。

 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案【题目】下列实验方案中,可以达到实验目的的是( )
选项 | 实验目的 | 实验方案 |
A | 检验亚硫酸钠是否变质 | 先将亚硫酸钠样品溶于水配成溶液,然后加入足量稀盐酸酸化,再加入 |
B | 除去苯中混有的苯酚 | 加入适量的溴水,充分反应后过滤,弃去沉淀 |
C | 除去NaCl晶体中混有 | 先将晶体溶于水配成溶液,然后蒸发结晶并趁热过滤弃去滤液 |
D | 检验 | 将 |
A.AB.BC.CD.D
【题目】下列实验操作、现象和结论均正确的是
选项 | 操作 | 现象 | 结论 |
A | ①将湿润的红色石蕊试纸靠近试管口
| 试纸不变色 |
|
B | ②中振荡后静置 | 下层液体颜色变浅 |
|
C | ③旋开活塞 | 观察到红色喷泉 |
|
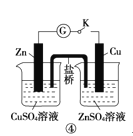
D | ④闭合开关K,形成原电池 | Zn极上有红色固体析出 | 锌的金属性比铜强 |
A.AB.BC.CD.D