题目内容
【题目】(1)常温下,向100mL0.01mol/LHA的溶液中逐滴加入0.02mol/LMOH溶液,所得溶液的pH随MOH溶液的体积变化如图所示(溶液体积变化忽略不计)。
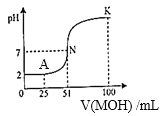
①由图中信息可知HA为______酸(填“强”或“弱”)。
②A点时,溶液中c(H+)、c(M+)、c(A-)由大到小的顺序是_____________;
③K点时,溶液中c(H+)+c(M+)-c(OH-)=_________mol/L。
(2)20℃时,在c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100mol/L的H2C2O4、NaOH混合溶液中,H2C2O4、HC2O4-、C2O42-的物质的量分数δ随溶液pH变化的关系如图所示。

①Q点:c(H2C2O4)______c(HC2O4-)(填“>”、“<”或“=”)
②该温度下HC2O4-的电离常数K=____________。
【答案】强 c(A-)>c(H+)>c(M+) 0.05 < 1×10-4.2
【解析】
(1)①根据开始滴定时溶液的pH与酸的浓度分析判断;
②X点溶质为等浓度的HA和NaA,HA为强电解质,完全电离,结合A-部分水解判断 c(H+)、c(M+)、c(A-)的浓度大小;
③K点反应后溶质为等浓度的MA和MOH,结合电荷守恒分析;
(2)①依据图象可知Q点c(H2C2O4)= c(C2O42-)≈0,c(HC2O4-)的浓度最大;
②P点c(HC2O4-)=c(C2O42-),据此计算该温度下HC2O4-的电离常数。
(1)①根据图甲可知,0.01mol/LHA溶液的pH=2,c(H+)=0.01mol/L=c(HA),说明HA为强酸;
②A点加入25mL0.02mol/LMOH,反应后溶质为等浓度的HA和MA,HA为强电解质,完全电离,则c(A-)的浓度最大,M+部分水解而消耗,则c(H+)>c(M+),因此溶液中c(H+)、c(M+)、c(A-)由大到小的顺序是:c(A-)>c(H+)>c(M+);
③K点时,根据电荷守恒可知:c(H+)+c(M+) –c(OH-)=c(A-)=![]() =0.005mol/L;
=0.005mol/L;
(2)①根据图乙可知,Q点c(H2C2O4)=c(C2O42-)≈0,c(HC2O4-)的浓度最大,则c(H2C2O4)< c(HC2O4-);
②P点c(HC2O4-)=c(C2O42-),该温度下HC2O4-的电离平衡常数Ka=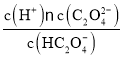 =c(H+)=1×10-4.2mol/L。
=c(H+)=1×10-4.2mol/L。

 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案【题目】CH4-CO2催化重整时发生反应:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g),不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。回答下列问题:
2CO(g)+2H2(g),不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。回答下列问题:
(1)某温度下,向1L的密闭容器中充入0.2molCH4与0.1molCO2,发生CH4-CO2催化重整反应,10min时达到平衡,测得平衡混合物中CO(g)的体积分数为20%,则用CH4表示的反应速率为______,CO2的平衡转化率为______。
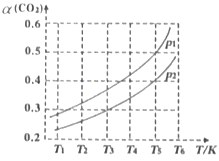
(2)若CO2的平衡转化率(a)与温度(T)、压强(p)的关系如图所示。由图可知:压强p1______p2(选填“>“、“<“或“=”),理由是______。
(3)在一定温度下,向固定容积为2L的密闭容器中充入0.1moCH4与0.1mo1CO2发生CH4-CO2催化重整反应,达平衡时CO2的平衡转化率为50%,则此条件下该反应的平衡常数为K=______;平衡后保持温度不变,若再充入0.15molCH4、0.15molCO2、0.1molCO、0.1molH2,则此时v正______(选填“>”、“<”或“=”)v逆。
(4)已知:C(s)+2H2(g)=CH4(g)△H1=-75 kJmol-1
C(s)+O2(g)=CO2(g)△H2=-394 kJmol-1
C(s)+![]() O2(g)=CO(g)△H3=-111 kJmol-1
O2(g)=CO(g)△H3=-111 kJmol-1
①催化重整反应CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)的△H=______kJmol-1。
2CO(g)+2H2(g)的△H=______kJmol-1。
②反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。相关数据如下表:
积碳反应CH4(g)=C(s)+2H2(g) | 消碳反应CO2(g)+C(s)=CO(g) | ||
△H/(kJmol-1) | 75 | 172 | |
活化能/(kJmol-1) | 催化剂X | 33 | 91 |
催化剂Y | 43 | 72 | |
由上表判断,催化剂X______Y(填“优于”或“劣于”),理由是______。


