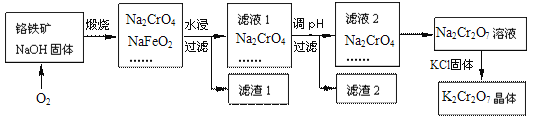
题目内容
【题目】炼锌烟尘(主要成份为ZnO,含少量CuO和FeO)为原料,可以制取氯化锌和金属锌。制取氯化锌主要工艺如下:
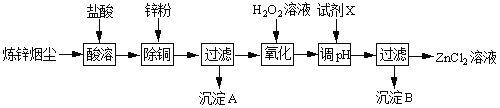
下表列出相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0molL1计算)。
金属离子 | Fe3+ | Zn2+ | Fe2+ |
开始沉淀的pH | 1.1 | 5.2 | 5.8 |
沉淀完全的pH | 3.2 | 6.4 | 8.8 |
(1)加入H2O2溶液的作用是___。
(2)流程图中,调节pH时,加入的试剂X可以是______(填序号),pH应调整到___。
A.ZnO B.NaOH C.Zn2(OH)2CO3 D.ZnSO4
【答案】使Fe2+被氧化为Fe3+ AC 3.2≤pH<5.2
【解析】
向炼锌烟尘(主要成份为ZnO,含少量CuO和FeO)中加盐酸溶解,金属氧化物与盐酸反应形成氯化锌、氯化铜、氯化亚铁溶液,加适量锌粉置换出Cu,然后过滤,滤液中含有Fe2+和Zn2+,向滤液中加过氧化氢把溶液中的Fe2+氧化为Fe3+,再加ZnO(或Zn(OH)2等)调节pH,使Fe3+转化为Fe(OH)3沉淀,过滤除去Fe(OH)3沉淀,得到ZnCl2溶液,以此来解答。
(1)由上述分析可知,加入H2O2溶液的作用是使溶液中的Fe2+氧化为Fe3+;
(2)调节溶液的pH时,要消耗溶液中的H+,但是不能引入杂质。ZnO、Zn(OH)2、Zn2(OH)2CO3均与H+反应生成Zn2+,消耗了H+,同时不引入杂质;NaOH可以调节溶液的pH,但会引入杂质Na+;ZnSO4与H+不能反应,不能调节溶液的pH,故合理选项是AC;
调节pH时,要使溶液中的Fe3+转化为Fe(OH)3沉淀,而Zn2+仍然以离子形式存在于溶液中,不形成沉淀,由表中数据可知pH≥3.2时,Fe3+完全沉淀,而Zn2+开始沉淀的pH为5.2,所以溶液pH调节范围为:3.2≤pH<5.2。

【题目】CH4-CO2催化重整时发生反应:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g),不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。回答下列问题:
2CO(g)+2H2(g),不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。回答下列问题:
(1)某温度下,向1L的密闭容器中充入0.2molCH4与0.1molCO2,发生CH4-CO2催化重整反应,10min时达到平衡,测得平衡混合物中CO(g)的体积分数为20%,则用CH4表示的反应速率为______,CO2的平衡转化率为______。
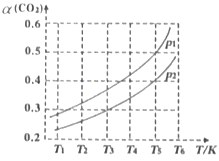
(2)若CO2的平衡转化率(a)与温度(T)、压强(p)的关系如图所示。由图可知:压强p1______p2(选填“>“、“<“或“=”),理由是______。
(3)在一定温度下,向固定容积为2L的密闭容器中充入0.1moCH4与0.1mo1CO2发生CH4-CO2催化重整反应,达平衡时CO2的平衡转化率为50%,则此条件下该反应的平衡常数为K=______;平衡后保持温度不变,若再充入0.15molCH4、0.15molCO2、0.1molCO、0.1molH2,则此时v正______(选填“>”、“<”或“=”)v逆。
(4)已知:C(s)+2H2(g)=CH4(g)△H1=-75 kJmol-1
C(s)+O2(g)=CO2(g)△H2=-394 kJmol-1
C(s)+![]() O2(g)=CO(g)△H3=-111 kJmol-1
O2(g)=CO(g)△H3=-111 kJmol-1
①催化重整反应CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)的△H=______kJmol-1。
2CO(g)+2H2(g)的△H=______kJmol-1。
②反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。相关数据如下表:
积碳反应CH4(g)=C(s)+2H2(g) | 消碳反应CO2(g)+C(s)=CO(g) | ||
△H/(kJmol-1) | 75 | 172 | |
活化能/(kJmol-1) | 催化剂X | 33 | 91 |
催化剂Y | 43 | 72 | |
由上表判断,催化剂X______Y(填“优于”或“劣于”),理由是______。