题目内容
【题目】A、B、C、D是原子序数依次递增的前四周期元素,A元素的正化合价与负化合价的代数和为零;B元素原子的价电子结构为nsnnpn;C元素基态原子s能级的电子总数比p能级的电子总数多1;D元素原子的M能层全满,最外层只有一个电子。请回答:
(1)A元素单质的电子式为________;B元素单质的一种空间网状结构的晶体,熔点>3550 ℃,该单质的晶体类型属于________________;基态D原子共有__________种不同运动状态的电子。
(2)A与C形成的最简单分子的中心原子杂化方式是__________,该分子与D2+、H2O以2∶1∶2的配比结合形成的配离子是_______(填化学式),此配离子中的两种配体的不同之处为_____________(填标号)。
①中心原子的价层电子对数 ②中心原子的孤电子对的对数
③中心原子的化学键类型 ④VSEPR模型
(3)1 mol BC-中含有的π键数目为________;写出与BC-互为等电子体的分子和离子各一种________、_________(填化学式)。
(4)D2+的硫酸盐晶体的熔点比D2+的硝酸盐晶体的熔点高,其原因是___________________________。
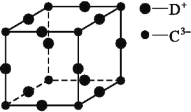
(5)D3C具有良好的电学和光学性能,其晶体的晶胞结构如图所示,D+和C3-半径分别为a pm、b pm,D+和C3-都是紧密接触的刚性小球,则C3-的配位数为________,晶体的密度为_____ g·cm-3。
【答案】H:H 原子晶体或混合晶体 29 sp3 [Cu(H2O)2(NH3)2]2+ ② 2NA CO或N2 C![]() 硫酸铜的晶格能比硝酸铜的晶格能高 6
硫酸铜的晶格能比硝酸铜的晶格能高 6 ![]()
【解析】
A、B、C、D是原子序数依次递增的前四周期元素,B元素原子的价电子结构为nsnnpn,则B为C,A元素的正化合价与负化合价的代数和为零,则A为H,C元素基态原子s能级的电子总数比p能级的电子总数多1,则C为N,D元素原子的M能层全满,最外层只有一个电子,则D为Cu。
(1)A元素单质为氢气,其电子式为H:H;B元素单质的一种空间网状结构的晶体,熔点>3550 ℃,该单质可能为金刚石或石墨,其晶体类型属于原子晶体或混合晶体;基态原子有多少个电子就有多少种不同运动状态的电子,因此基态D原子共有29种不同运动状态的电子;故答案为:H:H;原子晶体或混合晶体;29。
(2)A与C形成的最简单分子为氨气,中心原子价层电子对数![]() ,杂化方式是sp3,该分子与D2+、H2O以2∶1∶2的配比结合形成的配离子是[Cu(H2O)2(NH3)2]2+,两种配体中心原子的价层电子对数分别为
,杂化方式是sp3,该分子与D2+、H2O以2∶1∶2的配比结合形成的配离子是[Cu(H2O)2(NH3)2]2+,两种配体中心原子的价层电子对数分别为![]() 、
、![]() ;中心原子的孤电子对的对数,氨气有1对,水有2对;中心原子的化学键类型都为极性共价键;VSEPR模型都为四面体形;因此配离子中的两种配体的不同之处为②;故答案为:sp3;[Cu(H2O)2(NH3)2]2+;②。
;中心原子的孤电子对的对数,氨气有1对,水有2对;中心原子的化学键类型都为极性共价键;VSEPR模型都为四面体形;因此配离子中的两种配体的不同之处为②;故答案为:sp3;[Cu(H2O)2(NH3)2]2+;②。
(3)1 mol BC-即CN-,与氮气互为等电子体,因此1 mol CN-含有的π键数目为2NA;根据C-=N,O=N-,与BC-互为等电子体的分子和离子各一种CO或N2、![]() ;故答案为:2NA;CO或N2、
;故答案为:2NA;CO或N2、![]() 。
。
(4)D2+的硫酸盐晶体的熔点比D2+的硝酸盐晶体的熔点高,主要是硫酸根比硝酸根带的电荷多,硫酸铜的晶格能比硝酸铜的晶格能高;故答案为:硫酸铜的晶格能比硝酸铜的晶格能高。
(5)D3C具有良好的电学和光学性能,其晶体的晶胞结构如图所示,D+和C3-半径分别为a pm、b pm,D+和C3-都是紧密接触的刚性小球,根据结构分析,以顶点的N3分析,N3的配位数为6,晶胞中N3个数为1,Cu+个数为3,化学式为Cu3N,晶体的密度为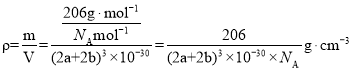 ;故答案为:6;
;故答案为:6;![]() 。
。

 阅读快车系列答案
阅读快车系列答案【题目】为达到下列实验目的,对应的实验方法以及相关解释均正确的是
选项 | 实验目的 | 实验方法 | 相关解释 |
A | 测量氯水的pH |
| pH试纸遇酸变红 |
B | 探究正戊烷C5H12催化裂解 |
| C5H12裂解为分子较小的烷烃和烯烃 |
C | 实验温度对平衡移动的影响 |
| 2NO2 |
D | 用AlCl3溶液制备AlCl3晶体 |
| AlCl3沸点高于溶剂水 |
A.AB.BC.CD.D