题目内容
【题目】晶体硅是制备太阳能电池板的主要原料,电池板中还含有硼、氮、钛、钻、钙等多种化学物质。
请回答下列问题:
(1) 区分晶体硼和无定形硼最可靠的科学方法为___________。第二周期元素的电负性按由小到大的顺序排列,B元素排在第__________位,其基态原子价层电子的电子云轮廊图为 _______________。
(2)硅酸根有多种结构形式,一种无限长链状结构如图1所示,其化学式为____________,Si原子的杂化类型为__________________。
(3) N元素位于元素周期表_____________区;基态N原子中,核外电子占据最高能级的电子云有______伸展方向。

(4)[Co(NH3)6]3+的几何构型为正八面体形,Co在中心。
①[Co(NH3)6]3+中,1个Co提供_______________个空轨道。
②若将[Co(NH3)6]3+中的两个NH3分子换成两个Cl-,可以形成_____________种不同的结构形式。
(5)—种由Ca、Ti、O三种元素形成的晶体的立方晶胞结构如图2所示。
①与Ti紧邻的Ca有___________________个。
②若Ca与O之间的最短距离为α pm,阿伏加德罗常数的值为NA,则晶体的密度ρ=______g· cm-3(用含α、NA的代数式表示)。
【答案】 X-射线衍射实验 3 球形、哑铃形 (或纺锤形) SiO32- [或(SiO3)n2n-] sp3 p 3 6 2 8 ![]()
【解析】(1)区分晶体和非晶体的最可靠的科学方法为X-射线衍射实验。同周期主族元素的电负性从左到右依次增强,所以B元素排在第三位。基态B原子的价层电子排布式为2s22p1,其中s能级的电子云轮廓图为球形,p能级的电子云晶体为哑铃形或纺锤形;(2)由图1可知,无限长链状结构的硅酸根的化学式为SiO32-,其中Si原子的价层电子对数是4,所以杂化轨道类型是sp3;(3)基态N原子的价层电子排布式 2s22p3,所以属于p区。p能级有3个轨道,因此电子云有3个伸展方向;(4)①1个Co离子有6个NH3分子作配体,每个配体提供1对孤对电子,故1个Co离子需提供6个空轨道。②由信息:[Co(NH3)6]3+的几何构型为正八面体形,Co在中心可推知,如果两个NH3分子换成两个Cl-,可替换邻位和对位,共有两种不同结构形式。(5)①根据均摊法可知每个晶胞中实际占用1个Ca、1个Ti、3个O,由晶胞结构可知与1个Ca紧邻的Ti有8个,根据二者的原子数目之比为1:1可知,与1个Ti紧邻的Ca也有8个;②根据晶胞结构可知,Ca与O原子核之间的最短距离为面对角线的一半,则晶胞棱长为![]() ,则晶体的密度
,则晶体的密度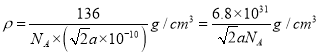 。
。

 黄冈创优卷系列答案
黄冈创优卷系列答案

