题目内容
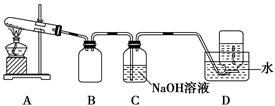
三氯化铬是化学合成中的常见物质,三氯化铬易升华,在高温下能被氧气氧化。制三氯化铬的流程如下:
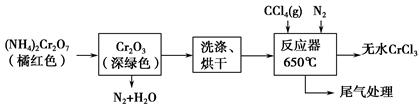
(1)重铬酸铵分解产生的三氧化二铬(Cr2O3难溶于水)需用蒸馏水洗涤,如何用简单方法判断其已洗涤干净?_____________________________。
(2)已知CCl4沸点为76.8 ℃,为保证稳定的CCl4气流,适宜的加热方式是________________。
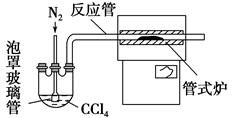
(3)用下图装置制备CrCl3时,反应管中发生的主要反应为Cr2O3+3CCl4=2CrCl3+3COCl2,则向三颈烧瓶中通入N2的作用为①____________________________;②________________________________。
(4)样品中三氯化铬质量分数的测定:称取样品0.330 0 g,加水溶解并定容于250 mL容量瓶中。移取25.00 mL于碘量瓶(一种带塞的锥形瓶)中,加热至沸后加入1 g Na2O2,充分加热煮沸,适当稀释,然后加入过量2 mol·L-1 H2SO4至溶液呈强酸性,此时铬以Cr2O存在,再加入1.1 g KI,加塞摇匀,充分反应后铬以Cr3+存在,于暗处静置5 min后,加入1 mL指示剂,用0.025 0 mol·L-1标准Na2S2O3溶液滴定至终点,平行测定三次,平均消耗标准Na2S2O3溶液24.00 mL。已知:
2Na2S2O3+I2=Na2S4O6+2NaI
①该实验可选用的指示剂名称为________,判定终点的现象是_______________________________________________________;
②加入Na2O2后要加热煮沸,其主要原因是____________________________;
③加入KI时发生反应的离子方程式为_______________________________;
④样品中无水三氯化铬的质量分数为________。(结果保留一位小数)

(1)重铬酸铵分解产生的三氧化二铬(Cr2O3难溶于水)需用蒸馏水洗涤,如何用简单方法判断其已洗涤干净?_____________________________。
(2)已知CCl4沸点为76.8 ℃,为保证稳定的CCl4气流,适宜的加热方式是________________。
(3)用下图装置制备CrCl3时,反应管中发生的主要反应为Cr2O3+3CCl4=2CrCl3+3COCl2,则向三颈烧瓶中通入N2的作用为①____________________________;②________________________________。

(4)样品中三氯化铬质量分数的测定:称取样品0.330 0 g,加水溶解并定容于250 mL容量瓶中。移取25.00 mL于碘量瓶(一种带塞的锥形瓶)中,加热至沸后加入1 g Na2O2,充分加热煮沸,适当稀释,然后加入过量2 mol·L-1 H2SO4至溶液呈强酸性,此时铬以Cr2O存在,再加入1.1 g KI,加塞摇匀,充分反应后铬以Cr3+存在,于暗处静置5 min后,加入1 mL指示剂,用0.025 0 mol·L-1标准Na2S2O3溶液滴定至终点,平行测定三次,平均消耗标准Na2S2O3溶液24.00 mL。已知:
2Na2S2O3+I2=Na2S4O6+2NaI
①该实验可选用的指示剂名称为________,判定终点的现象是_______________________________________________________;
②加入Na2O2后要加热煮沸,其主要原因是____________________________;
③加入KI时发生反应的离子方程式为_______________________________;
④样品中无水三氯化铬的质量分数为________。(结果保留一位小数)
(1)最后一次洗涤的流出液呈无色 (2)水浴加热(并用温度计指示温度) (3)①赶尽体系中的氧气 ②鼓气使反应物进入管式炉中进行反应 (4)①淀粉溶液 由蓝色变成无色,且半分钟内不变色 ②赶尽过量的过氧化钠与水反应得到的氧气,防止其与I-反应而产生I2 ③Cr2O72-+6I-+14H+=3I2+2Cr3++7H2O ④96.1%
(1)(NH4)2Cr2O7是易溶于水的铵盐,Cr2O3是不溶于水的,故用水可洗去未完全分解的(NH4)2Cr2O7等,而(NH4)2Cr2O7溶液是呈黄色的,若洗涤液没有颜色,则已洗净。(2)一般低于100 ℃时的加热都可采用水浴加热,水浴加热比较均匀、温度稳定,便于得到稳定的CCl4气流。(4)①一般地,生成I2或消耗I2的滴定反应,都选淀粉溶液做指示剂。生成I2的反应,其滴定终点的现象是溶液突然出现蓝色,且半分钟内不褪色。I2恰好反应至终点时的现象是蓝色突然消失,且半分钟内不恢复蓝色。②加入Na2O2后要加热煮沸,其主要原因是Na2O2会有部分与H2O反应,生成的O2可能会氧化溶液中的I-,造成实验数据误差,使实验结果偏高。④设样品中无水三氯化铬的质量分数为x,由原子守恒和电子守恒得如下关系:
CrCl3 ~ 3Na2S2O3
158.5 3
0.033 00x 0.025 0 mol·L-1×24.00×10-3L
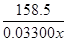 =
=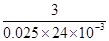 ,解得x=96.1%。
,解得x=96.1%。
CrCl3 ~ 3Na2S2O3
158.5 3
0.033 00x 0.025 0 mol·L-1×24.00×10-3L
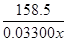 =
=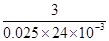 ,解得x=96.1%。
,解得x=96.1%。
练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目

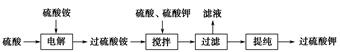
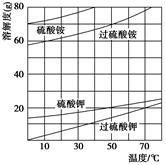
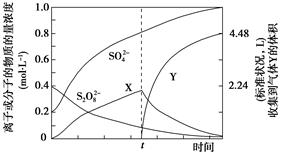
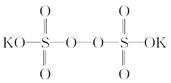 )具有强氧化性(常被还原为硫酸钾),80 ℃以上易发生分解。实验室模拟工业合成过硫酸钾的流程如下:
)具有强氧化性(常被还原为硫酸钾),80 ℃以上易发生分解。实验室模拟工业合成过硫酸钾的流程如下: