题目内容
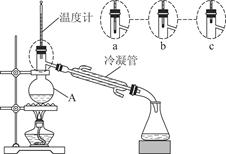
苯甲酸常用于抗真菌及消毒防腐。实验室常用高锰酸钾氧化甲苯制备苯甲酸,其装置如图甲所示(加热、搅拌和仪器固定装置均已略去)。实验过程如下:
①将5.4 mL甲苯、100 mL水、几粒沸石加入250 mL三颈烧瓶中;
②装上冷凝管,加热至沸后分批加入16 g高锰酸钾,回流反应4 h;
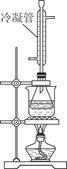
③将反应混合物趁热减压过滤,并用热水洗涤滤渣,将洗涤液并入滤液中;
④滤液加入盐酸酸化后,抽滤(装置如图乙)、洗涤、干燥得苯甲酸粗产品。
在苯甲酸制备过程中发生反应:

(1)图甲冷凝管中冷水应从________(填“a”或“b”)管进入,图乙中仪器X的名称为________。
(2)实验中分批加入KMnO4的原因是_________________________。
(3)判断甲苯被氧化完全的实验现象是___________________________。
(4)抽滤操作与普通过滤相比,除了得到沉淀较干燥外,还有一个优点是__________________________________________________________。
(5)第一次过滤时,若溶液呈红色,可加入下列试剂处理________(填字母)。
(6)苯甲酸在不同温度下溶解度见下表:
洗涤苯甲酸晶体时应用________洗涤。
①将5.4 mL甲苯、100 mL水、几粒沸石加入250 mL三颈烧瓶中;
②装上冷凝管,加热至沸后分批加入16 g高锰酸钾,回流反应4 h;
③将反应混合物趁热减压过滤,并用热水洗涤滤渣,将洗涤液并入滤液中;
④滤液加入盐酸酸化后,抽滤(装置如图乙)、洗涤、干燥得苯甲酸粗产品。
在苯甲酸制备过程中发生反应:

(1)图甲冷凝管中冷水应从________(填“a”或“b”)管进入,图乙中仪器X的名称为________。
(2)实验中分批加入KMnO4的原因是_________________________。
(3)判断甲苯被氧化完全的实验现象是___________________________。
(4)抽滤操作与普通过滤相比,除了得到沉淀较干燥外,还有一个优点是__________________________________________________________。
(5)第一次过滤时,若溶液呈红色,可加入下列试剂处理________(填字母)。
| A.H2O | B.CCl4 |
| C.NaHSO3 | D.HNO3 |
| T/℃ | 4 | 18 | 75 |
| 溶解度/g | 0.18 | 0.27 | 2.20 |
洗涤苯甲酸晶体时应用________洗涤。
(1)a 布氏漏斗
(2)控制氧化反应速率,防止发生暴沸
(3)甲苯层消失,回流液不再有明显的油珠
(4)过滤速度快
(5)C
(6)冷水
(2)控制氧化反应速率,防止发生暴沸
(3)甲苯层消失,回流液不再有明显的油珠
(4)过滤速度快
(5)C
(6)冷水
(1)无论冷凝管怎样放置,其冷凝或回流时,冷水一律从下进;X为布氏漏斗。(2)一次性加入KMnO4过多,会导致反应过于剧烈。(3)甲苯是不溶于水、密度比水小的有机物,其完全氧化时,回流液没有油珠。(4)抽滤速度快,效率高。(5)溶液呈红色,说明KMnO4过量,需加入还原剂处理,如NaHSO3。(6)温度越高,苯甲酸溶解度越大,用冷水洗涤可有效降低苯甲酸的溶解损失。

练习册系列答案
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案
相关题目

 CH3CH2CH2CHO
CH3CH2CH2CHO



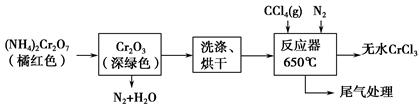
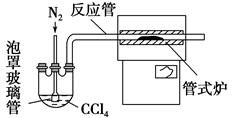
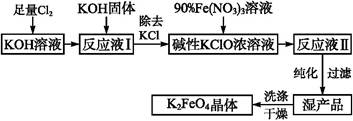
 KCl+KClO+H2O(条件:温度较低)
KCl+KClO+H2O(条件:温度较低) ;② 。
;② 。