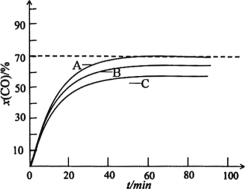
��Ŀ����
����Ŀ����֪ X��Y��Z��Q��R��E����ǰ������Ԫ���У�ԭ������X��Y��Z��Q��R��E����ṹ��������Ϣ�����
Ԫ�� | �ṹ��������Ϣ |
X | ԭ�ӵ�L����s����������p������ |
Y | ԭ�Ӻ����L����3��δ�ɶԵ��� |
Z | �ؿ��к�������Ԫ�� |
Q | ���ʳ��³�ѹ�������壬ԭ�ӵ�M������1��δ�ɶԵ�p���� |
R | �˵������Y��Q�ĺ˵����֮�� |
E | N�ܲ���ֻ��һ�����ӣ�K��L��M����������� |
�������Ϣ�ش��й����⣺
(1)д��Ԫ��Y��ԭ�Ӻ���۵����Ų�ͼ��___________��X��һ���⻯����Է�������Ϊ26��������е������������ļ���֮��Ϊ______��
(2)X��Y��Z����Ԫ�صĵ�һ�������ɸߵ��͵�����Ϊ(дԪ�ط���)_____��
(3)X��ZԪ�طֱ�����Ԫ���γɵ���������У��е�ϸߵ�Ϊ(д��ѧʽ)______��ԭ����________��
(4)XZ��Y2���ڵȵ����壬д��������XZ�Ľṹʽ��_____��
(5)R��һ�������Ļ�ѧʽΪRCl36H2O����֪0.01mol RCl36H2O��ˮ��Һ���ù�����������Һ����������0.02mol AgCl��������������������____��
A��[R(H2O)6]Cl3 B��[R(H2O)5Cl]Cl2H2O
C��[R(H2O)4Cl2]Cl2H2O D��[R(H2O)3Cl3]3H2O
(6)������ESO4��ˮ��Һ����ε��백ˮ��������ɫ��������Ӧ�����ӷ���ʽΪ��__�������μӰ�ˮ�������������ܽ⣬�õ�����ɫ��Һ��д����Ӧ�����ӷ���ʽΪ��__��
���𰸡�![]() 3��2 N��O��C H2O ˮ���Ӽ�����γ������ʹ�е����� C��O B Cu2++2NH3H2O=Cu(OH)2��+2NH4+ Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH��
3��2 N��O��C H2O ˮ���Ӽ�����γ������ʹ�е����� C��O B Cu2++2NH3H2O=Cu(OH)2��+2NH4+ Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH��
��������
Xԭ�ӵ�L����s����������p������������Ϊ̼(C)��Yԭ�Ӻ����L����3��δ�ɶԵ��ӣ�����۵����Ų�ʽΪ2s22p3��YΪ��(N)��ZΪ�ؿ��к�������Ԫ�أ���ZΪ��(O)��Q�ĵ��ʳ��³�ѹ�������壬ԭ�ӵ�M������1��δ�ɶԵ�p���ӣ�����Ϊ��(Cl)��R�ĺ˵������Y��Q�ĺ˵����֮�ͣ�����Ϊ��(Cr)��Eԭ�ӵ�N�ܲ���ֻ��һ�����ӣ�K��L��M����������ӣ�����Ϊͭ(Cu)��
�����Ϸ�����֪��X��Y��Z��M��R��E�ֱ�ΪC��N��O��Cl��Cr��Cu��
(1)Y�ǵ�Ԫ�أ���ԭ�Ӻ���۵����Ų�ͼΪ![]() ��X��һ���⻯����Է�������Ϊ26������ΪC2H2���ṹʽΪH-C��C-H��������е������������ĸ����ֱ�Ϊ3��2�����ֵΪ3:2����Ϊ��
��X��һ���⻯����Է�������Ϊ26������ΪC2H2���ṹʽΪH-C��C-H��������е������������ĸ����ֱ�Ϊ3��2�����ֵΪ3:2����Ϊ��![]() ��3:2��
��3:2��
(2)X��Y��ZΪC��N��O������Ԫ����Nԭ�ӵ�2p������Ӱ��������һ�����ܳ��ַ��������Ե�һ�������ɸߵ��͵�����ΪN��O��C����Ϊ��N��O��C��
(3)X��ZԪ������Ԫ���γɵ��������ֱ�ΪCH4��H2O��H2O���Ӽ����γ������������е���ַ�������е�ϸߵ���H2O��ԭ����ˮ���Ӽ�����γ������ʹ�е����ߡ���Ϊ��H2O��ˮ���Ӽ�����γ������ʹ�е����ߣ�
(4)CO��N2���ڵȵ����壬������CO�ĽṹʽΪC��O����Ϊ��C��O��
(5)��֪0.01mol RCl36H2O��ˮ��Һ���ù�����������Һ����������0.02mol AgCl������������������2��Cl-���ɴ˿�ȷ��������������[R(H2O)5Cl]Cl2H2O����ѡB����Ϊ��B��
(6)������CuSO4��ˮ��Һ����ε��백ˮ��������ɫ����Cu(OH)2����Ӧ�����ӷ���ʽΪCu2++2NH3H2O=Cu(OH)2��+2NH4+�������μӰ�ˮ�������������ܽ⣬�õ�����ɫ��Һ[Cu(NH3)4](OH)2����Ӧ�����ӷ���ʽΪCu(OH)2+4NH3=[Cu(NH3)4]2++2OH������Ϊ��Cu2++2NH3H2O=Cu(OH)2��+2NH4+��Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH����

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�