题目内容
【题目】甲酸钠是一种重要的化工原料。在0.5L真空密闭耐压容器中,将预先用95%乙醇水溶液配制的0.2LNaOH溶液加到容器,加热并搅拌,达到60℃恒温时,通入CO到一定压力,开始反应后记录容器压力随时间变化,直到压力不再变化,冷却,泄压,取出反应物,抽滤、烘干并称量。其反应如下:
Ⅰ:CO(g)+H2O(g)![]() HCOOH(aq) ΔH1 K1
HCOOH(aq) ΔH1 K1
Ⅱ:HCOOH(aq)+NaOH(aq)![]() HCOONa(s)+H2O(l) ΔH2 K2
HCOONa(s)+H2O(l) ΔH2 K2
Ⅲ:CO(g)+NaOH(aq)![]() HCOONa(s) ΔH K
HCOONa(s) ΔH K
请回答:
(1)K=___(用K1、K2表示),ΔH=___(用ΔH1、ΔH2表示)。
(2)若需加快反应Ⅲ的速率,下列措施可行的是___。
A.增大CO的初始压力 B.适当升高温度
C.减少乙醇浓度 D.降低搅拌转速
(3)CO的压力转化率可以反映羰基化进程。CO的压力转化率可以表示为:x(CO)=1-![]() ×100%,P0为CO初始压力,P1为CO某时刻分压。HCOONa收率可表示为:Y(HCOONa)=
×100%,P0为CO初始压力,P1为CO某时刻分压。HCOONa收率可表示为:Y(HCOONa)=![]() ×100%,n0(NaOH)表示投料NaOH的物质的量,n(HCOONa)表示生成HCOONa的物质的量。投料比r=
×100%,n0(NaOH)表示投料NaOH的物质的量,n(HCOONa)表示生成HCOONa的物质的量。投料比r=![]() 。
。
保持60℃恒温,以投料比r=0.7时,CO初始压力分别为0.5Mpa、1.5Mpa和2.0Mpa,测得x(CO)与t的关系如图所示。
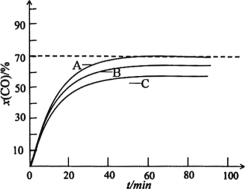
①表示1.5Mpa的曲线为___(用A、B、C表示)。
②若1.5Mpa时,Y(HCOONa)=87%,则NaOH的转化率为___。
③当CO初始压力为1.5Mpa,保持60℃恒温,不计HCOONa在乙醇中溶解。画出Y(HCOONa)与r示意图___。
【答案】K=K1![]() K2 ΔH=ΔH1+ΔH2 AB B 87%
K2 ΔH=ΔH1+ΔH2 AB B 87% 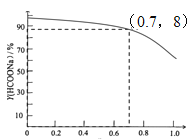
【解析】
(1).Ⅰ:CO(g)+H2O(g)![]() HCOOH(aq)
HCOOH(aq)
Ⅱ:HCOOH(aq)+NaOH(aq)![]() HCOONa(s)+H2O(l)
HCOONa(s)+H2O(l)
反应Ⅰ+反应Ⅱ得反应Ⅲ:CO(g)+NaOH(aq)![]() HCOONa(s) ;
HCOONa(s) ;
(2)根据影响反应速率的因素分析;
(3)①增大压强,平衡正向移动,压强越大,CO的平衡转化率越大;
②根据Y(HCOONa)=![]() ×100%计算NaOH的转化率;
×100%计算NaOH的转化率;
③根据题意,保持60℃恒温,以投料比r=0.7时,CO初始压力为1.5Mpa, Y(HCOONa)=87%,增大氢氧化钠的物质的量,氢氧化钠的转化率减小,随r增大,Y(HCOONa)减小;
(1).Ⅰ:CO(g)+H2O(g)![]() HCOOH(aq)
HCOOH(aq)
Ⅱ:HCOOH(aq)+NaOH(aq)![]() HCOONa(s)+H2O(l)
HCOONa(s)+H2O(l)
反应Ⅰ+反应Ⅱ得反应Ⅲ:CO(g)+NaOH(aq)![]() HCOONa(s) ;所以K=K1
HCOONa(s) ;所以K=K1![]() K2;根据盖斯定律ΔH=ΔH1+ΔH2;
K2;根据盖斯定律ΔH=ΔH1+ΔH2;
(2)A.增大压强,反应速率增大,增大CO的初始压力 ,能加快反应Ⅲ的速率,故选A; B.温度越高反应速率越快,适当升高温度,能加快反应Ⅲ的速率,故选B;
C.反应速率与氢氧化钠浓度有关,所以减少乙醇浓度,不能加快反应Ⅲ的速率,故不选C;
D.降低搅拌转速,反应速率减慢,故不选D。
(3)①增大压强,平衡正向移动,压强越大,CO的平衡转化率越大,所以表示1.5Mpa的曲线为B;
②设氢氧化钠的初始物质的量为amol,Y(HCOONa)=![]() ×100%=87%,则生成甲酸钠的物质的量为0.87amol,消耗氢氧化钠的物质的量是0.87amol, NaOH的转化率为
×100%=87%,则生成甲酸钠的物质的量为0.87amol,消耗氢氧化钠的物质的量是0.87amol, NaOH的转化率为![]() 87%;
87%;
③根据题意,保持60℃恒温,以投料比r=0.7时,CO初始压力为1.5Mpa, Y(HCOONa)=87%,增大氢氧化钠的物质的量,氢氧化钠的转化率减小,随r增大,Y(HCOONa)减小,所以Y(HCOONa)与投料比r的关系示意图为 。
。

 巧学巧练系列答案
巧学巧练系列答案【题目】已知 X、Y、Z、Q、R、E六种前四周期元素中,原子序数X<Y<Z<Q<R<E,其结构或性质信息如表:
元素 | 结构或性质信息 |
X | 原子的L层上s电子数等于p电子数 |
Y | 原子核外的L层有3个未成对电子 |
Z | 地壳中含量最多的元素 |
Q | 单质常温常压下是气体,原子的M层上有1个未成对的p电子 |
R | 核电荷数是Y与Q的核电荷数之和 |
E | N能层上只有一个电子,K、L、M层均排满电子 |
请根据信息回答有关问题:
(1)写出元素Y的原子核外价电子排布图:___________。X的一种氢化物相对分子质量为26,其分子中的σ键与π键的键数之比为______。
(2)X、Y、Z三种元素的第一电离能由高到低的排列为(写元素符号)_____。
(3)X、Z元素分别与氢元素形成的最简单化合物中,沸点较高的为(写化学式)______,原因是________。
(4)XZ与Y2属于等电子体,写出化合物XZ的结构式:_____。
(5)R的一种配合物的化学式为RCl36H2O。已知0.01mol RCl36H2O在水溶液中用过量硝酸银溶液处理,产生0.02mol AgCl沉淀。此配合物最可能是____。
A.[R(H2O)6]Cl3 B.[R(H2O)5Cl]Cl2H2O
C.[R(H2O)4Cl2]Cl2H2O D.[R(H2O)3Cl3]3H2O
(6)向含少量ESO4的水溶液中逐滴滴入氨水,生成蓝色沉淀,反应的离子方程式为:__,继续滴加氨水至过量,沉淀溶解,得到深蓝色溶液,写出反应的离子方程式为:__。