题目内容
【题目】下列各组中微粒能大量共存,且当加入试剂后反应的离子方程式书写正确的是( )
选项 | 微粒组 | 加入试剂 | 发生反应的离子方程式 |
A | Fe3+、I-、Cl- | NaOH溶液 | Fe3++3OH-===Fe(OH)3↓ |
B | K+、NH3·H2O、CO | 通入少量CO2 | 2OH-+CO2===CO |
C | H+、Fe2+、SO | Ba(NO3)2溶液 | SO |
D | Na+、Al3+、Cl- | 少量澄清石灰水 | Al3++3OH-===Al(OH)3↓ |
A. A B. B C. C D. D
【答案】D
【解析】Fe3+能氧化I-成为I2,所以不能共存,选项A错误。二氧化碳与氨水反应,但是一水合氨是一元弱碱,在离子方程式中不可以拆开,所以选项B错误。向含有H+、Fe2+、SO![]() 的溶液中加入硝酸钡溶液,因为硝酸钡溶液中有大量硝酸根离子,而原溶液有氢离子和亚铁离子,三个离子之间发生氧化还原反应,生成Fe3+和NO气体,选项C错误。向含有Na+、Al3+、Cl-的溶液中加入少量氢氧化钙溶液,会生成氢氧化铝沉淀,反应为:Al3++3OH-===Al(OH)3↓,选项D正确。
的溶液中加入硝酸钡溶液,因为硝酸钡溶液中有大量硝酸根离子,而原溶液有氢离子和亚铁离子,三个离子之间发生氧化还原反应,生成Fe3+和NO气体,选项C错误。向含有Na+、Al3+、Cl-的溶液中加入少量氢氧化钙溶液,会生成氢氧化铝沉淀,反应为:Al3++3OH-===Al(OH)3↓,选项D正确。

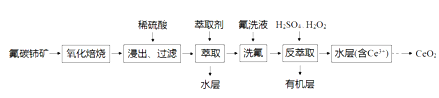
【题目】孔雀石的主要成分为Cu2(OH)2CO3,还含少量FeO、Fe2O3、SiO2。以下是实验室以孔雀石为原料制备CuSO4·5H2O晶体的流程图:
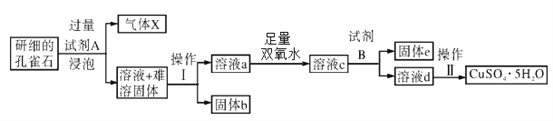
(1)试剂A的化学式为_____________;固体b的化学式为______________。
(2)生成气体X的化学方程式为_________________________________。
(3)已知:有关金属离子从开始沉淀到沉淀完全时溶液的pH如表所示
Fe3+ | Cu2+ | Fe2+ | |
开始沉淀的pH | 2.7 | 5.1 | 8.1 |
沉淀完全的pH | 3.0 | 6.7 | 9.6 |
加入足量双氧水的目的是___________________________________(用离子方程式表示)。设计实验方案证明加入的双氧水已足量_____________________________________(实验方案包括试剂、现象和结论)。
(4)① 试剂B的使用是为了调节溶液的pH,使Fe3+转化为沉淀予以分离。试剂B可选用__________________。
A.NaOH溶液 B. Cu C.CuO D.Cu2(OH)2CO3
② 为完全除去溶液c中的Fe3+而又不使Cu2+沉淀,则应调节溶液pH的范围为________________。
(5)操作Ⅱ包括__________________、洗涤、干燥。