题目内容
【题目】CeO2是一种重要的稀土氧化物,可利用氟碳铈矿(主要成分为CeFCO3)来制备。其工艺流程如下:

已知:I.Ce4+能与SO42-结合成[CeSO4]2+,与F-结合成[CeFx](4-x)+(0<x<4).
II.在硫酸体系中,Ce4+能被萃取剂萃取二Ce3+不能。
回答下列问题:
(1)“氧化焙烧”中“氧化”的目的是_________________。
(2)CeO2不溶于水和碱,微溶于酸,但“浸出”时却能溶解完全,原因是溶液中的_______(填原子符号,下同)、__________、_____________促进了CeO2的溶解。
(3)“反萃取”时发生反应的离子方程式为____________________。
(4)若缺少“洗氟”这一环节,则所得产品的质量将___________(填“偏大”“偏小”或“不变”)。
【答案】 将+3价铈氧化为+4价铈 H+ F- SO42- 2[CeSO4]2++H2O2===2Ce3++O2↑+2H++2SO42- 偏小
【解析】根据已知信息硫酸体系中Ce4+能被萃取剂萃取,而Ce3+不能,可推测第一步“氧化焙烧”的目的是将+3价铈氧化成+4价。第二步加入硫酸浸取,Ce4+与SO42-结合成[CeSO4]2+,Ce4+与F-结合成[CeFx](4-x)+;第三步加萃取剂,硫酸体系中Ce4+能被萃取剂萃取,Ce元素进入有机层;第四步,加入氟洗液,除去氟;第四步,加入硫酸和双氧水,根据后面的流程可知,此处双氧水为还原剂,将Ce4+还原为Ce3+,反萃取,Ce3+进入水层;加入碱后Ce3+转化为沉淀,通入氧气将Ce从+3价氧化为+4价,得到产品。
(1)“氧化焙烧”中“氧化”的目的是将+3价铈氧化成+4价,以便后续的提取。故答案为:将+3价铈氧化成+4价;
(2)CeO2微溶于酸,CeO2+4H+=Ce4++2H2O,根据信息Ce4+能与SO42-结合成[CeSO4]2+,与F-结合成[CeFx](4-x)+,故F、SO42促进了CeO2的溶解,故答案为:H+、F-、SO42-;
(3)反萃取时,H2O2为还原剂,将Ce4+还原为Ce3+,H2O2自身被氧化为O2,故离子方程式为:2[CeSO4]2++H2O2=2Ce3++O2↑+2H++2SO42-;
(4)若缺少“洗氟”, 部分Ce元素存在于[CeFx](4-x)+,难以被反萃取,进入有机层,则进入水层的Ce元素偏少,所得产品的质量将减少。故答案为:偏小。

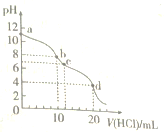
【题目】下列各组中微粒能大量共存,且当加入试剂后反应的离子方程式书写正确的是( )
选项 | 微粒组 | 加入试剂 | 发生反应的离子方程式 |
A | Fe3+、I-、Cl- | NaOH溶液 | Fe3++3OH-===Fe(OH)3↓ |
B | K+、NH3·H2O、CO | 通入少量CO2 | 2OH-+CO2===CO |
C | H+、Fe2+、SO | Ba(NO3)2溶液 | SO |
D | Na+、Al3+、Cl- | 少量澄清石灰水 | Al3++3OH-===Al(OH)3↓ |
A. A B. B C. C D. D