题目内容
【题目】无水AlCl3(183 ℃升华)遇潮湿空气即产生大量白雾,实验室可用下列装置制备。
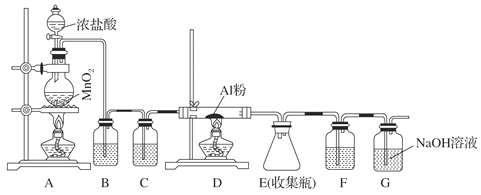
(1)其中装置A用来制备氯气,写出其离子反应方程式:_____________________________。
(2)装置B中盛放饱和NaCl溶液,该装置的主要作用是_____________________________。
(3)G为尾气处理装置,其中反应的化学方程式:___________________________________。
(4)制备氯气的反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,探究小组同学提出下列实验方案:与足量AgNO3溶液反应,称量生成的AgCl质量。此方案__________(填“可行”,“不可行”)并说明理由__________________________________________________。
【答案】 MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O 除去混在氯气中的氯化氢 Cl2+2NaOH=NaCl+NaClO+H2O 不可行 硝酸银不仅和过量的盐酸反应,也会和氯化锰反应生成沉淀
Mn2++Cl2↑+2H2O 除去混在氯气中的氯化氢 Cl2+2NaOH=NaCl+NaClO+H2O 不可行 硝酸银不仅和过量的盐酸反应,也会和氯化锰反应生成沉淀
【解析】(1)由装置图中的信息可知,A中反应的离子方程式为MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(2)装置B中盛放饱和NaCl溶液,其主要作用是除去混在氯气中的氯化氢;装置C中应盛放浓硫酸,用于干燥氯气;
(3)由于产物AlCl3(183 ℃升华)遇潮湿空气即产生大量白雾,所以装置F中应盛放浓硫酸,防止G中的水蒸气进入E中;G中盛放氢氧化钠溶液,用于吸收尾气,防止污染环境,反应的化学方程式为Cl2+2NaOH=NaCl+NaClO+H2O;
(4)残余液中有剩余的盐酸,还有生成的MnCl2,都能与AgNO3溶液反应生成AgCl,所以该方案不可行。

【题目】下列各组中微粒能大量共存,且当加入试剂后反应的离子方程式书写正确的是( )
选项 | 微粒组 | 加入试剂 | 发生反应的离子方程式 |
A | Fe3+、I-、Cl- | NaOH溶液 | Fe3++3OH-===Fe(OH)3↓ |
B | K+、NH3·H2O、CO | 通入少量CO2 | 2OH-+CO2===CO |
C | H+、Fe2+、SO | Ba(NO3)2溶液 | SO |
D | Na+、Al3+、Cl- | 少量澄清石灰水 | Al3++3OH-===Al(OH)3↓ |
A. A B. B C. C D. D


