题目内容
【题目】孔雀石的主要成分为Cu2(OH)2CO3,还含少量FeO、Fe2O3、SiO2。以下是实验室以孔雀石为原料制备CuSO4·5H2O晶体的流程图:
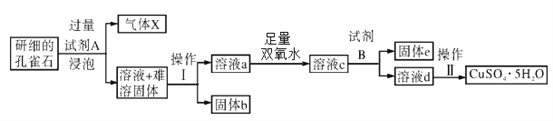
(1)试剂A的化学式为_____________;固体b的化学式为______________。
(2)生成气体X的化学方程式为_________________________________。
(3)已知:有关金属离子从开始沉淀到沉淀完全时溶液的pH如表所示
Fe3+ | Cu2+ | Fe2+ | |
开始沉淀的pH | 2.7 | 5.1 | 8.1 |
沉淀完全的pH | 3.0 | 6.7 | 9.6 |
加入足量双氧水的目的是___________________________________(用离子方程式表示)。设计实验方案证明加入的双氧水已足量_____________________________________(实验方案包括试剂、现象和结论)。
(4)① 试剂B的使用是为了调节溶液的pH,使Fe3+转化为沉淀予以分离。试剂B可选用__________________。
A.NaOH溶液 B. Cu C.CuO D.Cu2(OH)2CO3
② 为完全除去溶液c中的Fe3+而又不使Cu2+沉淀,则应调节溶液pH的范围为________________。
(5)操作Ⅱ包括__________________、洗涤、干燥。
【答案】 H2SO4 SiO2 Cu2(OH)2CO3 + 2H2SO4 = 2CuSO4 +CO2 ↑+ 3H2O 2Fe2++ H2O2 + 2H+ = 2Fe3++ 2H2O 取少量溶液c,向其中加入K3[Fe(CN)6]溶液,若未见蓝色沉淀生成,可证明H2O2 已经过量。(或 取少量溶液c,向其中加入MnO2,有大量气泡产生,可证明H2O2 已经过量。) C、D 3.0≤ pH <5.1 加热浓缩、冷却结晶、过滤
【解析】
(1)孔雀石的主要成分为Cu2(OH)2CO3,还含少量铁的氧化物和硅的氧化物,将孔雀石研磨然后加入试剂A浸泡,得到气体、溶液和固体,因为最终得到CuSO4,且能得到气体,试剂A为稀硫酸,化学式为:H2SO4 ;因为Cu2(OH)2CO3 、FeO、Fe2O3、都能和稀硫酸反应生成硫酸盐, SiO2 和稀硫酸不反应,所以固体b的化学式为: SiO2。故本题答案: H2SO4 . SiO2
(2)因为生成X为CO2化学方程式为: Cu2(OH)2CO3 + 2H2SO4 = 2CuSO4 +CO2 ↑+ 3H2O、(3)双氧水具有强氧化性,使用的目的是将溶液中的Fe2+转化为Fe3+,反应方程式为:2Fe2++ H2O2 + 2H+ = 2Fe3++ 2H2O;
要证明加入的双氧水已足量,取少量溶液c,向其中加入K3[Fe(CN)6]溶液,若未见蓝色沉淀生成,说明没有亚铁离子了,可证明H2O2 已经过量。(或 取少量溶液c,向其中加入MnO2,有大量气泡产生,可证明H2O2 已经过量。)
(4)①试剂C用于调节溶液pH,使Fe3+转化为沉淀予以分离,加入的物质能和稀硫酸反应,能将铁离子转化为沉淀,但不能引进新的杂质;然后过滤得到固体e和溶液d,容易分离。故答案:C D。
② 为完全除去溶液c中的Fe3+而又不使Cu2+沉淀,根据两种离子开始产生沉淀到沉淀完全溶液的PH为:Fe3+:2.7—3.0;Cu2+5.1—6.7则应调节溶液pH的范围为所以pH范围为3.0≤ pH <5.1,因此,本题正确答案是: 3.0≤ pH <5.1。
(5)操作Ⅱ将CuSO4溶液d加热浓缩、冷却结晶、过滤,洗涤、干燥得到五水硫酸铜。

【题目】下列各组中微粒能大量共存,且当加入试剂后反应的离子方程式书写正确的是( )
选项 | 微粒组 | 加入试剂 | 发生反应的离子方程式 |
A | Fe3+、I-、Cl- | NaOH溶液 | Fe3++3OH-===Fe(OH)3↓ |
B | K+、NH3·H2O、CO | 通入少量CO2 | 2OH-+CO2===CO |
C | H+、Fe2+、SO | Ba(NO3)2溶液 | SO |
D | Na+、Al3+、Cl- | 少量澄清石灰水 | Al3++3OH-===Al(OH)3↓ |
A. A B. B C. C D. D