题目内容
【题目】重金属元素铬的毒性较大,含铬废水需经处理达标后才能排放。
I.某工业废水中主要含有Cr3+,同时还含有少量的Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强。为回收利用,通常采用如下流程处理:
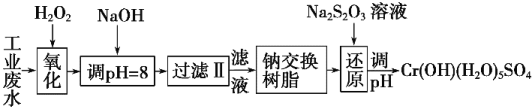
注:部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见下表。
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
pH | 3.7 | 9.6 | 11.1 | 8 | 9(>9溶解)[ |
(1)氧化过程中可代替H2O2的最佳试剂是 (填序号)。
A.Na2O2 B.FeCl3 C.KMnO4
(2)加入NaOH溶液调整溶液pH=8时,除去的离子是 (填序号);已知钠离子交换树脂的原理:Mn++nNaR―→MRn+nNa+,此步操作被交换除去的杂质离子是 (填序号)。
A.Fe3+ B.Al3+ C.Ca2+ D.Mg2+
II.酸性条件下,六价铬主要以Cr2O72-形式存在,工业上常用电解法处理含Cr2O72-的废水:该法用Fe作电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(3)电解时能否用Cu电极来代替Fe电极? (填“能”或“不能”),理由是: 。
(4)电解时阳极附近溶液中Cr2O72-转化为Cr3+的离子方程式为: 。
(5)常温下,Cr(OH)3的溶度积Ksp=1×10-32,当溶液中的c(Cr3+)=10-5 mol·L-1时,pH= 。
【答案】(1)A
(2)AB;CD
(3)不能;阳极产生的Cu2+不能使Cr2O72-还原到低价态
(4)Cr2 O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
(5)5
【解析】
试题分析:I.某工业废水中主要含有Cr3+,同时还含有少量的Fe3+、Al3+、Ca2+和Mg2+等,加双氧水把亚铁离子氧化为铁离子,同时Cr3+被氧化为Cr2O72-,加氢氧化钠调节pH=8,则Fe3+、Al3+转化为氢氧化铁和氢氧化铝沉淀,过滤,滤液中主要含有Cr2O72-、Ca2+和Mg2+等,通过钠离子交换树脂,除去Ca2+和Mg2+,然后加Na2S2O3把Cr2O72-还原为8Cr3+,再调节pH得到Cr(OH)(H2O)5SO4。
(1)加氧化剂主要目的是把亚铁离子氧化为铁离子,同时不能引入新的杂质,所以可以用Na2O2代替H2O2,故答案为:A;
(2)根据表中数据可知,pH=8时,Fe3+、Al3+转化为氢氧化铁和氢氧化铝沉淀,则Fe3+、Al3+被除去;通过钠离子交换树脂,除去Ca2+和Mg2+;故答案为:AB;CD;
II.(1)若用Cu电极来代替Fe电极,在阳极上铜失去电子得到的阳离子是铜离子,该离子不具有还原性,不能和重铬酸根之间发生反应,故答案为:不能;因阳极产生的Cu2+不能使Cr2O72-还原到低价态;
(2)Cr2O72-具有强氧化性,可以将亚铁离子氧化为铁离子,自身被还原为2Cr3+,反应的实质是:6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O,故答案为:6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O;
(3)当c(Cr3+)=10-5mol/L时,溶液的c(OH-)=![]() =10-9 mol/L,c(H+)═
=10-9 mol/L,c(H+)═![]() =10-5mol/L,pH=5,即要使c(Cr3+)降至10-5mol/L,溶液的pH应调至5,故答案为:5。
=10-5mol/L,pH=5,即要使c(Cr3+)降至10-5mol/L,溶液的pH应调至5,故答案为:5。

 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案