题目内容
【题目】氧化石墨烯基水凝胶是一类新型复合材料,常用 Hummers 法制备氧化石墨烯,具体方法为:将石墨粉和无水 NaNO3 混合后置于浓硫酸中并用冰浴冷却,再用 KMnO4 溶液进行氧化处理,最后用 H2O2 处理即可得到氧化石墨烯。请回 答下列问题。
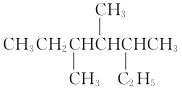
(1)锗(Ge)元素与碳元素同族,基态 Ge 原子的外围电子排布式是_____。与锗同周期且基态原子未成对 电子数与 Ge 原子相同的元素有_____(用元素符号表示)。
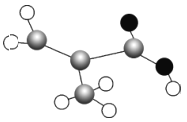
(2)对氧化石墨烯进行还原可得到还原氧化石墨烯,二者的结构如图所示:
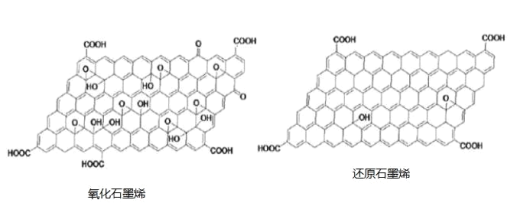
①还原石墨烯中碳原子的杂化形式是___________________ 。
②二者当中在水溶液中溶解度更大的是____________ (填物质名称),原因为__________________。
(3)NaNO3 中 NO3- 的空间构型为_____,写出两种与 NO3- 的互为等电子体的分子的分子式_____。
(4)金属钾晶体和金属锰晶体的三维空间堆积方式均为体心立方堆积。
①上述两种晶体原子在二维平面放置方式均为_____(填“密置层”或“非密置层”)。
②金属钾和金属锰的熔点分别为 63℃和 1244℃,金属锰的熔点高于金属钾熔点的原因为___________。
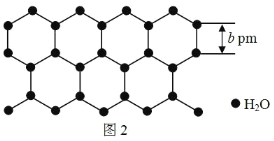
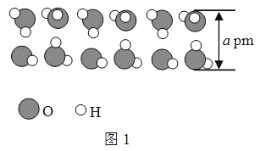
(5)中国科学家首次证明了二维冰的存在,二维冰是由两层六角冰无旋转堆垛而成,两层之间靠氢键连接,每个水分子与面内水分子形成三个氢键,与面外水分子形成一个氢键,二维冰结构的模型示意图的侧视图 如图 1 所示,厚度为 a pm,俯视图如图 2 所示,距离最近的两个水分子间的距离为 b pm,设阿伏加德罗常 数的值为 N,二维冰的密度是________________ g·cm3。
【答案】4s24p2 Ti、Ni、Se sp3和sp2 氧化石墨烯 氧化石墨烯中含有的羟基和羧基更多,与水分子间形成的氢键更多,溶解度更大 平面三角形 SO3、BF3 非密置层 锰离子半径比钾离子半径小,价电子数更多,形成的金属键强 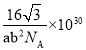
【解析】
⑴锗(Ge)元素与碳元素同族,Ge原子电子排布式是1s22s22p63s23p63d104s24p2,锗基态原子有2个未成对电子。
⑵①还原石墨烯羧基中的碳原子是3个σ键,无孤对电子,还有4个σ键的碳。
②氧化石墨烯中含有的羟基和羧基比还原石墨烯多,与水分子间形成的氢键更多。
⑶先计算NaNO3中NO3-的价层电子对数,根据价电子N-= O =F+ = S和B2=N,书写与NO3-的互为等电子体的分子的分子式。
⑷①提心立方堆积在二维平面放置方式均为非密置层;②锰离子半径比钾离子半径小,带电荷多,形成的金属键强。
⑸结合图像可知二维冰可看做由棱长为bpm、高为apm的六棱柱堆积而成,先计算每个六棱柱的体积,根据均摊法得到每个六棱柱水分子个数,再氨二维冰的密度。
⑴锗(Ge)元素与碳元素同族,Ge原子电子排布式是1s22s22p63s23p63d104s24p2,基态Ge原子的外围电子排布式是4s24p2。锗基态原子有2个未成对电子,与锗同周期且基态原子未成对电子数与Ge原子相同的元素有Ti、Ni、Se;故答案为:4s24p2;Ti、Ni、Se。
⑵①还原石墨烯羧基中的碳原子是3个σ键,无孤对电子,因此为sp2杂化,还原石墨烯还有4个σ键的碳,其杂化形式是sp3杂化;故答案为:sp3和sp2。
②氧化石墨烯中含有的羟基和羧基比还原石墨烯多,与水分子间形成的氢键更多,溶解度更大,因此二者当中在水溶液中溶解度更大的是氧化石墨烯;故答案为:氧化石墨烯;氧化石墨烯中含有的羟基和羧基更多,与水分子间形成的氢键更多,溶解度更大。
⑶NaNO3中NO3-的价层电子对数![]() ,其空间构型为平面三角形,根据价电子N-= O =F+ = S和B2=N,因此与NO3-的互为等电子体的分子的分子式SO3、BF3;故答案为:平面三角形;SO3、BF3。
,其空间构型为平面三角形,根据价电子N-= O =F+ = S和B2=N,因此与NO3-的互为等电子体的分子的分子式SO3、BF3;故答案为:平面三角形;SO3、BF3。
⑷①上述两种晶体原子在二维平面放置方式均为非密置层;故答案为:非密置层。
②锰离子半径比钾离子半径小,带电荷多,形成的金属键强,因此金属锰的熔点高于金属钾熔点;故答案为:锰离子半径比钾离子半径小,价电子数更多,形成的金属键强。
⑸结合图像可知二维冰可看做由棱长为bpm、高为apm的六棱柱堆积而成,每个六棱柱的体积为![]() ,根据均摊法可知每个六棱柱平均含有水分子个数
,根据均摊法可知每个六棱柱平均含有水分子个数![]() ,因此二维冰的密度每个六棱柱的质量
,因此二维冰的密度每个六棱柱的质量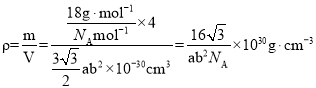 ;故答案为:
;故答案为: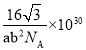 。
。

 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案【题目】(1)用0.1mol/LNaOH溶液分别滴定体积均为20.00mL、浓度均为0.1mol/L的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。
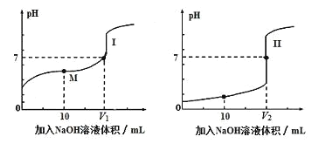
①滴定醋酸的曲线是____(填“I”或“II”)。
②V1和V2的关系:V1____V2(填“>”、“=”或“<”)。
③M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是____。
(2)为了研究沉淀溶解平衡和沉淀转化,某同学查阅资料并设计如下实验。查阅资料:AgSCN是白色沉淀,相同温度下,溶解度:AgSCN>AgI。
操作步骤 | 现象 |
步骤1:向2mL0.005mol/LAgNO3溶液中加入2mL0.005mol/LKSCN溶液,静置。 | 出现白色沉淀 |
步骤2:取1mL上层清液于试管中,滴加1滴mol/LFe(NO3)3溶液。 | 溶液变红色 |
步骤3:向步骤2的溶液中,继续加入5滴3mol/LAgNO3溶液。 | 现象a,溶液红色变浅 |
步骤4:向步骤1中余下的浊液中加入5滴3mol/LKI溶液。 | 出现黄色沉淀 |
①写出步骤2中溶液变红色的离子方程式____。
②步骤3中现象a是____。
③用化学平衡原理解释步骤4的实验现象____。