题目内容
【题目】氨氮(NH3、NH4+等)是一种重要污染物,可利用合适的氧化剂氧化去除。
(1)氯气与水反应产生的HClO可去除废水中含有的NH3。
已知:NH3(aq)+HClO(aq)=NH2Cl(aq)+H2O(l) ΔH=a kJ·mol-1
2NH2Cl(aq)+HClO(aq)=N2(g)+H2O(l)+3H+(aq)+3Cl-(aq) ΔH=b kJ·mol-1
则反应2NH3(aq)+3HClO(aq)=N2(g)+3H2O(l)+3H+(aq)+3Cl-(aq)的ΔH=________kJ·mol-1。
(2)在酸性废水中加入NaCl进行电解,阳极产生的HClO可氧化氨氮。电解过程中,废水中初始Cl-浓度对氨氮去除速率及能耗(处理一定量氨氮消耗的电能)的影响如图所示。
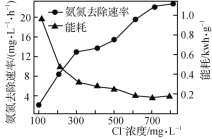
①写出电解时阳极的电极反应式:________________。
②当Cl-浓度减小时,氨氮去除速率下降,能耗却增加的原因是____________________________。
③保持加入NaCl的量不变,当废水的pH低于4时,氨氮去除速率也会降低的原因是____________________________。
(3)高铁酸钾(K2FeO4)是一种高效氧化剂,可用于氨氮处理。K2FeO4在干燥空气中和强碱性溶液中能稳定存在。氧化剂的氧化性受溶液中的H+浓度影响较大。
①碱性条件下K2FeO4可将水中的NH3转化为N2除去,该反应的离子方程式为________________________________。
②用K2FeO4氧化含氨氮废水,其他条件相同时,废水pH对氧化氨氮去除率及氧化时间的影响如图所示。当pH小于9时,随着pH的增大,氨氮去除率增大、氧化时间明显增长的原因是_________________。

【答案】2a+b Cl--2e-+H2O=HClO+H+ Cl-电解产生的HClO浓度低,氧化氨氮速率低,阳极OH-放电,消耗电能 当H+过大,HClO氧化Cl-产生Cl2从溶液中逸出,使HClO浓度减小 2NH3+2FeO42-+2H2O=2Fe(OH)3↓+N2↑+4OH- 随着pH的增大K2FeO4的稳定性增强,利用率提高,氨氮去除率高;但H+浓度减小,氧化性减弱,氧化时间增长
【解析】
(1)根据盖斯定律计算解答;
(2)①电解时阳极发生氧化反应,失电子,元素化合价升高,;结合题意据此分析电极反应式;
②结合阳极电极反应分析原因;
③阳极产生的HClO,具有氧化性,酸性条件下氧化性增强,不但可氧化氨氮,也可以氧化氯离子;
(3)高铁酸钾(K2FeO4)是一种高效氧化剂,可用于氨氮处理。K2FeO4在干燥空气中和强碱性溶液中能稳定存在。氧化剂的氧化性受溶液中的H+浓度影响较大。
①碱性条件下K2FeO4可将水中的NH3转化为N2除去,根据氧化还原反应电荷守恒和物料守恒书写反应的离子方程式;
②用K2FeO4氧化含氨氮废水,说明K2FeO4具有强氧化性,根据酸性强弱对氧化性的影响分析。
(1)已知:①NH3(aq)+HClO(aq)=NH2Cl(aq)+H2O(l) ΔH=a kJ·mol-1
②2NH2Cl(aq)+HClO(aq)=N2(g)+H2O(l)+3H+(aq)+3Cl-(aq) ΔH=b kJ·mol-1
根据盖斯定律:①×2+②可得反应2NH3(aq)+3HClO(aq)=N2(g)+3H2O(l)+3H+(aq)+3Cl-(aq)的ΔH=2a+b kJ·mol-1;
(2)①电解时阳极发生氧化反应,失电子,元素化合价升高,在酸性废水中加入NaCl进行电解,阳极产生的HClO,氯元素的化合价升高失电子,阳极电极反应式为:Cl--2e-+H2O=HClO+H+;
②阳极电极反应式为:Cl--2e-+H2O=HClO+H+,当Cl-浓度减小时,Cl-电解产生的HClO浓度低,氧化氨氮速率低,阳极OH-放电,消耗电能;
③阳极产生的HClO,具有氧化性,酸性条件下氧化性增强,当废水的pH低于4时,H+浓度过大,HClO氧化性增强,可氧化Cl-产生Cl2从溶液中逸出,使HClO浓度减小,氨氮去除速率也会降低;
(3)①碱性条件下K2FeO4可将水中的NH3转化为N2除去,铁元素化合价由+6价降低为+3价,碱性条件下应生成Fe(OH)3沉淀,氮元素化合价由-3价升高为0价,根据氧化还原反应电荷守恒和物料守恒,反应的离子方程式为2NH3+2FeO42-+2H2O=2Fe(OH)3↓+N2↑+4OH-;
②用K2FeO4氧化含氨氮废水,说明K2FeO4具有强氧化性,氧化性受溶液中的H+浓度影响较大,随着pH的增大K2FeO4的稳定性增强,利用率提高,氨氮去除率高;但H+浓度减小,氧化性减弱,氧化时间增长。

 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案