题目内容
14.某次实验需用0.4mol•L-1 NaOH溶液480mL.配制方法如下:(1)配制该溶液应选用500mL容量瓶;
(2)用托盘天平准确称量8.0g 固体NaOH;
(3)将称量好的NaOH固体放在500mL大烧杯中,倒入约300mL蒸馏水,用玻璃棒搅拌,使固体全部溶解,待待溶液冷却至室温后后,将烧杯中的溶液注入容量瓶中;
(4)用少量蒸馏水洗涤烧杯2-3次,洗涤后的溶液一起转入容量瓶中,轻轻晃动容量瓶,使溶液混合均匀;
(5)向容量瓶中加入蒸馏水,到液面1~2cm时,改用胶头滴管加蒸馏水至液面最低点与刻度线相切盖好瓶塞,上下颠倒.混合均匀.
(6)若在配制过程中出现下列情况,将使所配制的NaOH溶液的浓度偏高的是CE,偏低的是DF,对实验结果没有影响的是AB(填各选项的序号).
A.用托盘天平称量一定质量固体NaOH时,所用的小烧杯内壁不太干燥
B.配制溶液所用的容量瓶洗净后没有烘干
C.固体NaOH在烧杯中溶解后,立即将溶液转移到容量瓶内并接着进行后续操作
D.转移溶液后,未洗涤烧杯和玻璃棒就直接定容
E.最后确定NaOH溶液体积(定容)时,俯视观察液面与容量瓶刻度线
F.定容摇匀后静止,发现液面低于刻度线,再加蒸馏水至刻度线.
分析 (1)一定容积的容量瓶只能配制相应体积的溶液,根据溶液的体积480mL,但容量瓶的规格没有480mL,容量瓶体积要大于480mL且相近;
(2)利用n=cv计算出氢氧化钠的物质的量,再根据m=nM计算所需氢氧化钠的质量;
(3)氢氧化钠溶解放出大量的热,溶液具有热胀冷缩的性质,故应先冷却至室温再移液定容;
(4)为保证溶质尽可能转移到容量瓶中,需用少量蒸馏水洗涤烧杯2-3 次,并将洗涤液一起转入容量瓶中;
(5)向容量瓶中加入蒸馏水,到液面 1-2cm时,改用胶头滴管加蒸馏水至液面最低点与刻度线相切,盖好瓶塞,上下颠倒混合均匀;
(6)分析操作对溶质的物质的量或对溶液的体积的影响,根据c=$\frac{n}{V}$分析判断.
解答 解:(1)因溶液的体积480mL,但容量瓶的规格没有480mL,所以选用500mL容量瓶,
故答案为:500;
(2)需氢氧化钠的质量为m=0.5L×0.4mol•L-1×40g/mol=8.0g,
故答案为:8.0;
(3)氢氧化钠溶解放出大量的热,溶液具有热胀冷缩的性质,影响溶液体积,故应先冷却至室温,
故答案为:待溶液冷却至室温后;
(4)为保证溶质尽可能转移到容量瓶中,需用少量蒸馏水洗涤烧杯2-3 次,并将洗涤液一起转入容量瓶中,
故答案为:2-3;一起转入容量瓶中;
(5)向容量瓶中加入蒸馏水,到液面离刻度线1-2cm时,改用胶头滴管加蒸馏水至液面最低点与刻度线相切,然后盖好瓶塞,上下颠倒混合均匀,
故答案为:1~2cm时;胶头滴管;至液面最低点与刻度线相切;
(6)A.用托盘天平称量一定质量固体NaOH时,所用的小烧杯内壁不太干燥,不影响氢氧化钠的质量,对溶液浓度无影响;
B.配制溶液所用的容量瓶洗净后没有烘干,对溶液浓度无影响;
C.液体具有热胀冷缩的性质,氢氧化钠溶解放热,未冷却到室温,趁热将溶液到入容量瓶,并配成了溶液,会导致溶液体积偏小,溶液浓度偏高;
D.转移溶液后,未洗涤烧杯和玻璃棒就直接定容,少量氢氧化钠沾在烧杯壁与玻璃棒上,氢氧化钠的实际质量减小,溶液浓度偏低;
E.定容时,俯视容量瓶刻度线,使溶液的体积偏低,所以溶液浓度偏高;
F.定容摇匀后静止,液面低于刻度线,一部分溶液留在瓶塞与瓶口之间,再加蒸馏水至刻度线,导致溶液体积偏大,所以溶液浓度偏低.
所以偏高的有CE,偏低有DF,无影响的是AB,
故答案为:CE;DF;AB.
点评 本题考查了配制一定物质的量浓度的溶液方法,题目难度中等,明确配制步骤为解答关键,注意掌握配制过程中误差分析的方法与技巧,试题培养了学生的分析能力及化学实验能力.

| A. | 硫酸的摩尔质量是98 g | |
| B. | 氯原子的摩尔质量等于氯的相对原子质量 | |
| C. | 标准状况下,任何物质的摩尔体积都约是22.4 L | |
| D. | 1 mol氧气的质量为32 g |
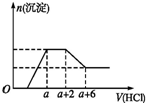 某溶液中可能含有OH-、CO32-、AlO2-、SiO32-、SO42-、Na+、Fe3+、Mg2+、Al3+.当向该溶液中加入一定物质的量浓度的盐酸时,发现生成沉淀物质的量随盐酸的体积变化如图所示,下列说法正确的是( )
某溶液中可能含有OH-、CO32-、AlO2-、SiO32-、SO42-、Na+、Fe3+、Mg2+、Al3+.当向该溶液中加入一定物质的量浓度的盐酸时,发现生成沉淀物质的量随盐酸的体积变化如图所示,下列说法正确的是( )| A. | 原溶液一定含有Na2SO4 | |
| B. | 反应最后形成的溶液中的溶质为NaCl | |
| C. | 原溶液中一定含有的阴离子是OH-、CO32-、AlO2-、SiO32- | |
| D. | 原溶液中含有CO32-与AlO2-的物质的量之比为1:1 |
| A. | H2(g)+Cl2(g)═2HCl(g)△H=-184.6kJ/mol | |
| B. | CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-802.3kJ/mol | |
| C. | 2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ/mol | |
| D. | CO(g)+O2(g)═CO2(g)△H=-258 kJ/mol |
| A. | 氧化镁与稀硝酸反应:O2-+2H+═H2O | |
| B. | 向稀硫酸溶液中撒入铁粉 2Fe+6H+=2Fe3++3H2↑ | |
| C. | 向碳酸钙中加入盐酸 CO32-+2H+=H2O+CO2↑ | |
| D. | 向氢氧化钠溶液中通入少量二氧化碳 2OH-+CO2=CO32-+H2O |
| A. | 向某溶液中,先加入氯水后滴入KSCN溶液,若溶液呈红色,则说明溶液中含有Fe2+ | |
| B. | 用铂丝蘸取待测液放在火焰上灼烧,若火焰呈黄色,则说明待测液中含有钠离子,不含钾离子 | |
| C. | 分液时,分液漏斗中下层液体从下口放出后,将上层液体从上口倒入另一个洁净的烧杯中 | |
| D. | 蒸馏时,应将温度计的水银球插入蒸馏烧瓶内的混合液体中 |
| A. | 5种 | B. | 4种 | C. | 3种 | D. | 2种 |
