题目内容
【题目】某学习小组的同学利用下列氧化还原反应设计原电池:2KMnO4+10FeSO4+8H2SO4==2MnSO4+5Fe2(SO4)3+K2SO4+8H2O。盐桥中装有饱和K2SO4溶液,下列叙述中正确的是
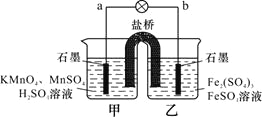
A.乙烧杯中发生还原反应
B.甲烧杯中溶液的pH逐渐减小
C.电池工作时,盐桥中的SO42-移向甲烧杯
D.外电路的电流方向是从a到b
【答案】D
【解析】
试题分析:A、根据方程式可知硫酸亚铁被氧化,所以该原电池反应是高锰酸根离子氧化亚铁离子为铁离子,所以乙烧杯发生氧化反应,A错误;B、甲烧杯发生还原反应,电极反应为: MnO4-+5e-+8H+=Mn2++4H2O,甲烧杯中溶液的pH逐渐升高,B错误;C、原电池中的阴离子向负极移动,所以硫酸根离子向甲烧杯移动,C错误;D、根据以上分析,a是正极,b是负极,则电流方向是从正极向负极流动,D正确;答案选D。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】下表为元素周期表的一部分,请回答有关问题:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
二 | ① | ② | ||||||
三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
(1)①和④的元素符号是________和________;
(2)表中最活泼的金属是________,非金属性最强的元素是________(填元素符号,下同);
(3)⑥的原子结构示意图为_____________;
(4)表中能形成两性氢氧化物的元素是________,写出该元素的氢氧化物与③最高价氧化物的水化物反应的化学方程式:___________________________________;
(5)⑦、⑧的氢化物热稳定性较强的是________(填氢化物化学式)。
【题目】下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:
族 周期 | IA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(1)上述十种元素中,最高价氧化物水化物酸性最强的化合物的化学式是___________,(填化学符号,下同),最高价氧化物水化物碱性最强的化合物的化学式是_____________,最高价氧化物水化物显两性的氢氧化物的化学式是_____________。
(2)③与④的气态氢化物的稳定性由大到小的顺序是_____________。
(3)④、⑤、⑥的离子半径由大到小的顺序是__________________。
(4)①、③形成的阳离子的电子式是______________。
(5)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:______________。
