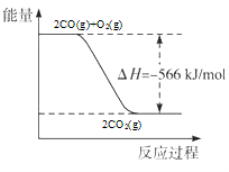
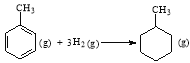题目内容
【题目】关于某酸的酸式盐NaHY的水溶液的下列叙述中,正确的是
A.该酸式盐的水溶液一定显酸性
B.在该盐溶液中,离子浓度为:c(Na+)>c(Y2-)>c(HY-)>c(OH-)>c(H+)
C.若HY-能水解,水解方程式为:HY-+H2O![]() Y2-+H3O+
Y2-+H3O+
D.若HY-能电离,电离方程式为:HY-+H2O![]() Y2-+H3O+
Y2-+H3O+
【答案】D
【解析】
试题分析:A、NaHY溶液由于Y2-没有指定,常见的有三种情况:①NaHSO4,只电离,不水解;②NaHSO3,其水溶液中HSO3-电离程度大于水解程度,溶液显酸性;③NaHCO3、NaHS,其水溶液中HCO3-、HS-水解程度大于电离程度,溶液显碱性。因Y2-不确定,A错误;B、根据A中分析可知B错误;C、为电离方程式而非水解方程式,水解方程式为HY-+H2O![]() H2Y+OH-,C错误;D、根据C中分析可知D正确,答案选D。
H2Y+OH-,C错误;D、根据C中分析可知D正确,答案选D。

 每课必练系列答案
每课必练系列答案【题目】元素周期表是学习化学的重要工具,它隐含着许多信息和规律。根据下表中短周期元素的原子半径和主要化合价,回答表后的问题。
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
原子半径(10-10m) | 0.74 | 1.60 | 0.53 | 1.10 | 0.99 | 1.11 | 0.75 | 1.43 |
最高或最低化合价 | +2 | +1 | +5 | +7 | +2 | +5 | +3 | |
-2 | -3 | -1 | -3 |
(1)上述元素中与元素⑧处于同一周期的有______________________(填元素符号)
(2)元素①在元素周期表中的位置是_______________________
(3)①④⑦三种元素的氢化物的稳定性由强到弱的顺序为__________________(填化学式)
(4)请写出下列元素形成的常见化合物的电子式:
③⑤_____________ ②⑤_____________ ③⑦_____________
(5)请写出⑤⑧两种元素的最高价氧化物对应水化物间反应的离子方程式:_________________________。