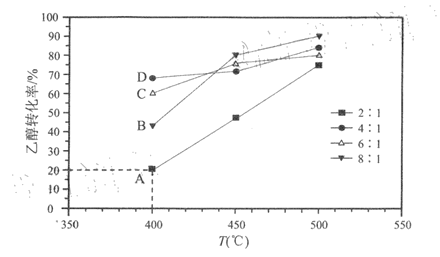
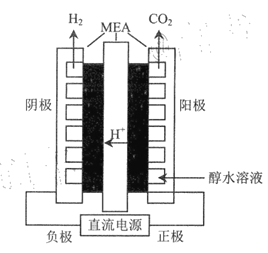
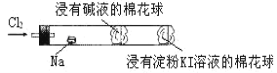
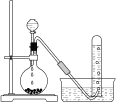
题目内容
【题目】瑞典化学家舍勒在研究软锰矿矿石时,把浓盐酸和软锰矿矿石混合加热,意外得到了氯气,MnO2 + 4HCl(浓)![]() MnCl2 + Cl2 ↑+ 2H2O 关于该反应的叙述不正确的是
MnCl2 + Cl2 ↑+ 2H2O 关于该反应的叙述不正确的是
A.MnO2是氧化剂B.HCl具有还原性
C.MnO2被HCl还原D.氧化剂与还原剂的物质的量之比为1:4
【答案】D
【解析】
A、MnO2中Mn的化合价由+4价降为+2价,故MnO2是氧化剂,A正确;
B、HCl中Cl的化合价由-1价升为0价,故HCl是还原剂,即HCl具有还原性,B正确;
C、MnO2是氧化剂,HCl是还原剂,则MnO2被HCl还原,C正确;
D、4份HCl在该反应中,有2份HCl体现酸性,另外2份HCl体现还原性,此时需要1份氧化剂MnO2,故氧化剂与还原剂的物质的量之比为1:2,D错误;
故选D。

练习册系列答案
相关题目